题目内容
10.向21.6g Fe3O4、Fe2O3、FeO、Cu的混合物中加入0.5mol•L-1的硫酸溶液420mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )| A. | 1.12 g | B. | 2.24 g | C. | 3.36 g | D. | 6.40 g |
分析 向21.6g Fe3O4、Fe2O3、FeO、Cu的混合物中加入硫酸溶液中,固体恰好完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,硫酸中H元素与混合物中O元素结合守恒水,由水的分子式H2O可知,故n(O)=n(H2SO4),若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为混合物中氧元素的质量.
解答 解:向21.6g Fe3O4、Fe2O3、FeO、Cu的混合物中加入硫酸溶液中,固体恰好完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,硫酸中H元素与混合物中O元素结合守恒水,由水的分子式H2O可知,故n(O)=n(H2SO4)=0.42L×0.5mol/L=0.21mol,
若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为氧化物中氧元素的质量,
所以固体减少的质量为:0.21mol×16g/mol=3.36g,
故选C.
点评 本题考查氧化还原反应的计算,题目难度中等,判断氧化物中氧原子的物质的量是解题的关键,注意掌握守恒思想在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法正确的是( )
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mo-l,逆反应的活化能为Eb kJ•mol-l,则△H=-( Ea-Eb)kJ.mol-l | |
| B. | 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
1.SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是( )
①KMnO4(H+,aq) ②品红溶液③溴水④氯水⑤Fe3+(aq)
①KMnO4(H+,aq) ②品红溶液③溴水④氯水⑤Fe3+(aq)
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
18.依据元素周期表及元素周期律,下列推断正确的是( )
| A. | H2SiO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
5.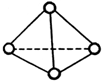 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
2.下列关于0.5mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
19.在指定环境中可能大量共存的离子组是( )
| A. | 强碱性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能与铝放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 无色溶液中Ca2+、Cu2+、ClO-、NO3- |
 自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
