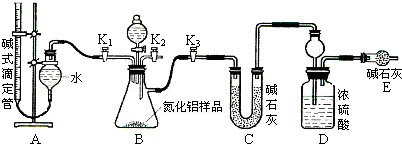
题目内容
将11.7克氯化钠跟10g 98%的浓硫酸反应在微热条件下,将生成的气体用100mL水完全吸收,问生成盐酸的质量分数为多少?若所得溶液的密度为1.05g/ml,则完全吸收后溶液的物质的量浓度为多少?
考点:化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:发生反应:NaCl+H2SO4
NaHSO4+HCl↑,进行过量计算,根据不足量的物质计算生成HCl的物质的量,溶液质量=水的质量+氯化氢的质量,进而计算生成盐酸的质量分数,再根据c=
计算式盐酸物质的量浓度.
| ||
| 1000ρω |
| M |
解答:
解:11.7克氯化钠的物质的量为
=0.2mol,
10g 98%的浓硫酸中n(H2SO4)=
=0.1mol,
根据NaCl+H2SO4
NaHSO4+HCl↑,0.2molNaCl完全反应需要0.2mol硫酸,大于0.1mol,故硫酸不足,反应生成0.1molHCl,其质量为0.1mol×36.5g/mol=3.65g,溶液质量为100g+3.65g=103.65g,故所得溶液质量分数为
×100%=3.52%,
所得溶液的密度为1.05g/ml,则完全吸收后溶液的物质的量浓度为
mol/L=1.01mol/L,
答:溶液质量分数为3.52%,溶液物质的量浓度为1.01mol/L.
| 11.7g |
| 58.5g/mol |
10g 98%的浓硫酸中n(H2SO4)=
| 10g×98% |
| 98g/mol |
根据NaCl+H2SO4
| ||
| 3.65g |
| 103.65g |
所得溶液的密度为1.05g/ml,则完全吸收后溶液的物质的量浓度为
| 1000×1.05×3.52% |
| 36.5 |
答:溶液质量分数为3.52%,溶液物质的量浓度为1.01mol/L.
点评:本题考查化学方程式计算、物质的量浓度计算,涉及过量计算,中学对应HCl的制备现在涉及较少,为易错题目,原理是利用高沸点酸制备挥发性酸,注意微热条件下生成硫酸氢钠,强热条件下生成硫酸钠.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
(Ⅰ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的醇溶液混和加热;(Ⅱ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的水溶液混和加热,则下列说法正确的是( )
| A、(Ⅰ)(Ⅱ)产物均相同 |
| B、(Ⅰ)(Ⅱ)产物均不同 |
| C、(Ⅰ)产物相同,(Ⅱ)产物不同 |
| D、(Ⅰ)产物不同,(Ⅱ)产物相同 |
铁丝与氧气或水蒸气反应的共同产物是( )
| A、FeO |
| B、Fe3O4 |
| C、Fe2O3 |
| D、Fe2O3和Fe3O4 |
科学家P?Tatapudi等人首先使用在空气中电解水(酸性)的方法,在阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2?3H2O2+O3,下列说法正确的是( )
| A、阳极反应:3O2+6e-+6H+=3H2O2 |
| B、氧化性:O2>O3 |
| C、电解一段时间后,溶液pH下降 |
| D、每转移3 mol电子,可生成标准状况下22.4 L O3 |
下列关于离子晶体的描述不正确的是( )
| A、离子晶体是阳离子和阴离子通过静电吸引力结合而成的晶体 |
| B、晶格能由大到小:NaF>NaCl>NaBr>NaI |
| C、硬度:MgO>CaO>BaO |
| D、在氯化钠晶体中,Na+和Cl-的配位数均为6 |
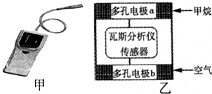 瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )
瓦斯爆炸是煤矿开采中的重大危害及事故发生源,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时会自动报警,大大减少了事故发生率.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y学科王2O3-Na2O,O2-可以在其中自由移动.则下列有关叙述不正确的是( )| A、电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B、电极b是正极,O2-由电极b流向电极a |
| C、瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| D、当固体电解质中有1 molO2-通过时,电子转移2 mol |