题目内容
科学家P?Tatapudi等人首先使用在空气中电解水(酸性)的方法,在阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2?3H2O2+O3,下列说法正确的是( )
| A、阳极反应:3O2+6e-+6H+=3H2O2 |
| B、氧化性:O2>O3 |
| C、电解一段时间后,溶液pH下降 |
| D、每转移3 mol电子,可生成标准状况下22.4 L O3 |
考点:电解原理
专题:电化学专题
分析:由阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2═3H2O2+O3,阳极反应为3H2O→O3+6H++6e-,阴极反应为6H++3O2+6e-→3H2O2,以此来解答.
解答:
解:A.阳极反应为3H2O→O3+6H++6e-,故A错误;
B.由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性强弱顺序为O2>H2O,不能确定与O3的关系,故B错误;
C.由电解反应可知,消耗水,则氢离子的浓度增大,pH变小,故C正确;
D.由阳极反应为3H2O→O3+6H++6e-,则每生成1molO3转移电子数为6mol,故D错误;
故选C.
B.由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性强弱顺序为O2>H2O,不能确定与O3的关系,故B错误;
C.由电解反应可知,消耗水,则氢离子的浓度增大,pH变小,故C正确;
D.由阳极反应为3H2O→O3+6H++6e-,则每生成1molO3转移电子数为6mol,故D错误;
故选C.
点评:本题为信息习题,考查电解原理,明确电解反应及阳极制得臭氧,阴极制得过氧化氢是解答本题的关键,难度不大.

练习册系列答案
相关题目
某有机物是药物生产的中间体,其结构如图.下列有关叙述不正确的是( )
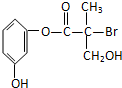

| A、该有机物与浓溴水可发生取代反应,1 mol该有机物可消耗3 mol溴 |
| B、该有机物与浓硫酸混合共热可发生消去反应 |
| C、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| D、1 mol该有机物催化加氢最多消耗3 mol氢气 |
下列叙述正确的是( )
| A、晶体中只要有阳离子就一定有阴离子 |
| B、金刚石和冰在熔化时克服的作用力相同 |
| C、HCl晶体由H+和Cl-构成 |
| D、原子晶体里,所有原子都以共价键相互结合 |
下列物质的性质、用途正确的是( )
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、明矾和漂白粉常用于自来水的净化,两者的作用原理完全相同 |
| C、Na2SiO3是制备硅胶和木材防火剂的原料 |
| D、合金的硬度比纯金属大,熔点也比纯金属高 |
等物质的量的CH4和NH3相比较,下列结论错误的是?( )
| A、它们的分子个数比为1:1 |
| B、它们的原子个数比为5:4 |
| C、它们的电子个数比为1:1 |
| D、它们的体积比为1:1 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: