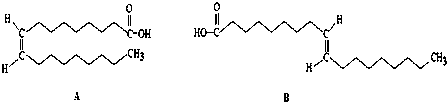
题目内容
4.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 在NaHCO3溶液中:K+、Cl-、AlO2-、SO42- | |
| B. | 加入铝粉能产生H2的溶液中:Na+、Fe3+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:SO32-、NO3-、K+ | |
| D. | 含有大量MnO4-的溶液中:H+、Ca2+、K+、Cl-、C2O42- |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;
B.加入铝粉能产生H2的溶液中存在大量氢离子或氢氧根离子,铁离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气;
C.c(OH-)/c(H+)=1012的溶液中存在大量氢氧根离子,三种离子之间不反应,都不与氢氧根离子反应;
D.酸性条件下高锰酸根离子能够氧化草酸跟离子,钙离子与草酸跟离子反应.
解答 解:A.NaHCO3、AlO2-之间反应生成氢氧化铝沉淀和碳酸钠,在溶液中不能大量共存,故A错误;
B.加入铝粉能产生H2的溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,Fe3+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,故B错误;
C.c(OH-)/c(H+)=1012的溶液呈碱性,溶液中存在大量氢氧根离子,SO32-、NO3-、K+之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.MnO4-在酸性条件下能够氧化C2O42-,Ca2+、C2O42-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.瓦斯中甲烷和氧气的质量比为1:4时极易发生爆炸.此时甲烷与氧气的下列物理量之比也为1:4的是( )
| A. | 物质的量之比 | B. | 体积比 | C. | 碳、氧原子个数比 | D. | 氢、氧原子个数比 |
15.下列叙述正确的是( )
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
12.下列高分子化合物的单体为一种的是( )
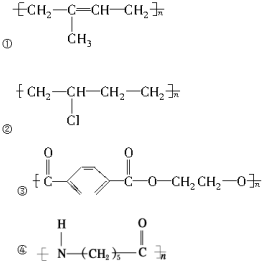

| A. | ①④ | B. | ②③ | C. | ①② | D. | ③④ |
9.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 蔗糖溶液、葡萄糖溶液、乙酸 | B. | 苯、己烷、环己烷 | ||
| C. | 苯、醋酸、己烯 | D. | 乙醇、硝基苯、己烷 |
13.科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究NO2可能被NaOH溶液完全吸收生成NaNO2和NaNO3 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
14.下列叙述正确是的( )
| A. | 人工固氮的过程一定涉及到氧化还原反应 | |
| B. | 简单的金属阳离子只有氧化性,简单的非金属阴离子只有还原性 | |
| C. | 1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 | |
| D. | 发生化学反应时,得电子越多的物质,氧化能力越强 |