题目内容
9.下列各组有机物只用一种试剂无法鉴别的是( )| A. | 蔗糖溶液、葡萄糖溶液、乙酸 | B. | 苯、己烷、环己烷 | ||
| C. | 苯、醋酸、己烯 | D. | 乙醇、硝基苯、己烷 |
分析 A.可用氢氧化铜鉴别;
B.只用一种试剂不能鉴别;
C.可用溴水鉴别;
D.可用水鉴别.
解答 解:A.蔗糖溶液、葡萄糖溶液、乙酸分别加入新制备氢氧化铜浊液(可加热),现象分别为无现象、生成砖红色沉淀、沉淀溶解,可鉴别,故A不选;
B.密度均比水小,且均不溶于水,利用化学性质一种试剂不能鉴别,故B选;
C.苯、醋酸、己烯分别与溴水混合,现象分别为不反应(萃取)、不分层,无明显现象、溴水褪色,现象不同,可鉴别,故C不选;
D.乙醇溶于水,硝基苯不溶于水,密度比水大,己烷不溶于水,密度比水小,可鉴别,故D不选.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及反应中的现象为解答的关键,注意现象相同不能鉴别物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | KOH | C. | NH3•H2O | D. | H2SO4 |
20.某化学小组用如图装置做兴趣实验(具支试管中存有少量空气).
完成下列填空:
(1)实验1:同时加入试剂,反应开始可观察到U形管中液面b(填字母,下同),反应结束静置一段时间,最终U形管中液面c.
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后,U形管中液面出现左低右高,则b管中发生反应的氧化剂是O2(填化学式).
(3)实验3:一段时间后,红棕色气体在b(填“a”或“b”)管液面上方出现,简述另外一试管未出现任何现象的原因:铝在浓硝酸中发生钝化.在其他条件不变的情况下,若将a、b试管中浓硝酸同时改为3mLcd(填编号),即可观察到试管中产生无色的气体,且位置与上述是相反的.
a.无水乙醇 b.浓硫酸 c.稀硫酸 d.烧碱溶液
(4)实验4:一段时间后,U形管中的液面情况是左高右低(用文字简述);写出a试管中发生还原反应的电极反应式:O2+2H2O+4e-═4OH-.
| 实验编号 | a中试剂 | b中试剂 | 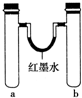 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
(1)实验1:同时加入试剂,反应开始可观察到U形管中液面b(填字母,下同),反应结束静置一段时间,最终U形管中液面c.
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后,U形管中液面出现左低右高,则b管中发生反应的氧化剂是O2(填化学式).
(3)实验3:一段时间后,红棕色气体在b(填“a”或“b”)管液面上方出现,简述另外一试管未出现任何现象的原因:铝在浓硝酸中发生钝化.在其他条件不变的情况下,若将a、b试管中浓硝酸同时改为3mLcd(填编号),即可观察到试管中产生无色的气体,且位置与上述是相反的.
a.无水乙醇 b.浓硫酸 c.稀硫酸 d.烧碱溶液
(4)实验4:一段时间后,U形管中的液面情况是左高右低(用文字简述);写出a试管中发生还原反应的电极反应式:O2+2H2O+4e-═4OH-.
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 在NaHCO3溶液中:K+、Cl-、AlO2-、SO42- | |
| B. | 加入铝粉能产生H2的溶液中:Na+、Fe3+、Cl-、NO3- | |
| C. | c(OH-)/c(H+)=1012的溶液中:SO32-、NO3-、K+ | |
| D. | 含有大量MnO4-的溶液中:H+、Ca2+、K+、Cl-、C2O42- |
14.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝; F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 .
.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨(或光化学烟雾);
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”).
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液(或铁氰化钾溶液),若溶液紫色褪去(或产生蓝色沉淀),则产品中含有Fe2+.
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为
 .
.
1.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
18.随着卤素原子核电荷数的递增,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
19.下列情况下,反应速率相同的是( )
| A. | 等体积0.1mol/L HCl和0.01mol/L HCl反应 | |
| B. | 等质量锌粒和镁粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等量1 mol/L碳酸钠溶液 | |
| D. | 等体积0.2 mol/HCl 和0.1 mol/L H2SO4 与等量等表面积的石灰反应 |