题目内容
3.试验中,下列实验操作正确的是( )| A. | 用试管取试剂瓶中的碳酸钠溶液时,发现取量过多,为了不浪费立即把多余的试剂倒入原试剂瓶中 | |
| B. | 硝酸钡溶于水,故可将含硝酸钡的废液倒入水槽,再用水冲入下水道 | |
| C. | 用蒸发的方法使氯化钠从溶液中析出,应将蒸发皿中的氯化钠溶液全部加热蒸干 | |
| D. | 稀释浓硫酸时,将浓硫酸缓缓注入水中,并不断搅拌 |
分析 A、实验室做实验剩余的药品,也要“三不”:不拿出实验室,不拿随意丢弃,不能放回原瓶;
B、硝酸钡是重金属盐;
C、蒸发结晶时将溶液全部蒸干容易引起晶体的迸溅;
D、浓硫酸稀释放热.
解答 解:A、实验剩余的药品不能放回原瓶,否则会污染药品,故A错误;
B、硝酸钡是重金属盐,有毒,会引起环境污染,故B错误;
C、蒸发结晶时将溶液全部蒸干容易引起晶体的迸溅,故应当有大量晶体析出、少量晶体剩余时即停止加热,剩余的液体用余热蒸干,故C错误;
D、浓硫酸稀释放热,故应将浓硫酸注入水中,故D正确.
故选D.
点评 本题考查化学实验安全问题,为高频考点,涉及物质分离提纯、基本实验操作等知识点,明确实验原理及基本操作规范性是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 | |
| B. | 两种元素组成的分子中一定只有极性键 | |
| C. | 只含共价键的物质,一定是共价化合物 | |
| D. | 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
6.在明矾溶液中逐滴加入Ba(OH)2溶液,不可能发生的反应的离子方程式是( )
| A. | Al3++SO42-+Ba2++3OH-→BaSO4↓+Al(OH)3↓ | |
| B. | Al3++2SO42-+2Ba2++4OH-→BaSO4↓+AlO2- | |
| C. | 2 Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ | |
| D. | 4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2Al(OH)3↓+2AlO2- |
18.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| B. | 0.1 mol CnH2n+2中含有的共用电子对数为0.3nNA | |
| C. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| D. | 电解精炼铜时,阳极质量减少64g,则阴极得到的电子数为2NA |
8.下列叙述正确的是( )
| A. | 氧化性:F2<Cl2<Br2<I2 | |
| B. | 次氯酸能杀死病菌,所以氯气可用于自来水的消毒 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
15.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1 L 1mol/L的硫酸钠溶液中,所含Na+数为NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe含有原子数NA |
13.在工业生产中,人们不断地寻找新的催化剂,主要目的是( )
| A. | 使反应更完全 | B. | 使吸热反应变成放热反应 | ||
| C. | 降低生产能耗 | D. | 改变反应途径 |
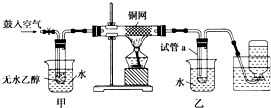 某实验小组用下列装置进行乙醇催化氧化的实验.
某实验小组用下列装置进行乙醇催化氧化的实验.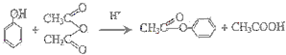
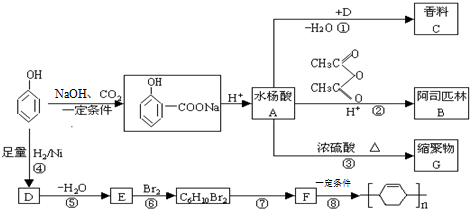
 ,G的结构简式
,G的结构简式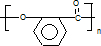 .
.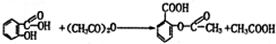 .
.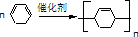 .
.