题目内容
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | SO2有还原性 | 用SO2可使溴水褪色 |
D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
C
【解析】
试题分析:A.NH4Cl是强酸弱碱盐,若将NH4Cl溶液加热,氯化铵会发生水解反应产生HCl和NH3·H2O,当溶液蒸干后NH4Cl固体会发生分解反应,产生氨气和HCl,因此不能制取NH4Cl固体,错误;B。Fe3+会与SCN-发生络合反应产生血红色物质,因此用KSCN溶液可以鉴别Fe3+,错误;C.SO2有还原性,会被溴水中的溴单质氧化为硫酸而使溶液褪色,正确;D.Cl2能够与碱发生反应产生盐,盐再与酸发生反应会产生有漂白性的HClO,因此可以用Cl2可与石灰乳反应制备含氯消毒剂,错误。
考点:考查物质的性质及用途的知识。

(10分)聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3 -  ]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、 0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________
(2)固体产物成分的探究
【实验设计】
实验步骤 | 现象 |
步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解。 | 固体溶解,没有观察 到气泡,溶液呈黄色 |
步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液振荡 | 溶液呈血红色 |
步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡。 | KMnO4的紫红色不褪去 |
【思考与判断】 根据上面的信息,可以确定固体产物的成分是________;
步骤1中发生反应的离子方程式为
(3)气体产物成分的探究(不考虑水蒸气)
【提出假设】 假设1:所得气体的成分是SO3 假设2:所得气体的成分是SO2、O2
假设3:所得气体的成分是
【设计实验方案,验证假设】按下表的实验步骤写出预期现象与结论。
实验操作 | 预期现象与结论 |
步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①
② |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1 mol·L-1的BaCl2溶液,充分振荡 | 结合步骤1中的②
|
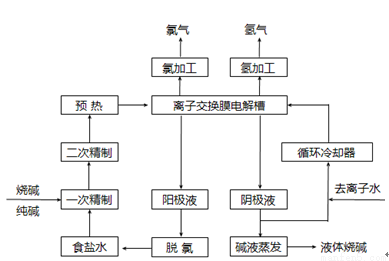
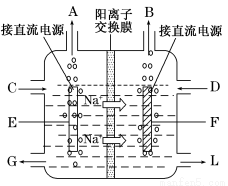
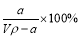
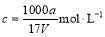
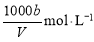






 生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。