题目内容
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm—1,质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是( )
A.溶质的质量分数为ω=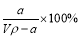
B.溶质的物质的量浓度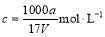
C.溶液中c (OH—)=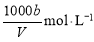
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5 ω
B
【解析】
试题分析:A.溶质的质量分数为ω=a÷(a+v)×100%,错误;B.溶质的物质的量浓度c= ,正确;C.溶液中c (OH—)=c (NH4+)+c(H+), c (NH4+)=
,正确;C.溶液中c (OH—)=c (NH4+)+c(H+), c (NH4+)= ,所以c (OH—)>
,所以c (OH—)>  ,错误;D.对于氨水来说,浓度越大,密度越小,所以上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5 ω,错误。
,错误;D.对于氨水来说,浓度越大,密度越小,所以上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5 ω,错误。
考点:考查溶液在稀释过程中质量分数、物质的量浓度的计算的知识。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案(8分)海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图: (2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是: ;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.5 | 11.0 |
Cr(OH)3 | 4.3 | 5.0 |
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,
则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ;
③过滤后,为能得到纯净Mg Cl2晶体,采用的操作方法是: ;
.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | SO2有还原性 | 用SO2可使溴水褪色 |
D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |


 D.纤维素的通式:(C6H12O6)n
D.纤维素的通式:(C6H12O6)n