题目内容
5.化学平衡常数K的大小与温度的关系是:温度升高,K的变化为c(填序号a.“一定增大”、b.“一定减小”或c.“可能增大也可能减小”).分析 若正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:若正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,若正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,由于正反应反应是放热反应还是吸热反应未知,故平衡常数可能增大也可能减小,
故答案为:c.
点评 本题考查化学平衡影响因素、平衡常数影响因素,比较基础,注意平衡常数只受温度影响.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
20.一定条件下各取1L的CH4和C2H6完全燃烧,分别放出227.3kJ和394.7kJ热量.现有甲烷和乙烷混合气体1L在相同条件下完全燃烧放出260.8kJ热量,此混合气体中氢原子和碳原子的物质的量之比为( )
| A. | 3.3:1 | B. | 3.5:1 | C. | 3.7:1 | D. | 3.9:1 |
4.下列说法不正确的是( )
| A. | 双键、三键中都含有π键 | |
| B. | 成键原子间原子轨道重叠愈多,共价键愈牢固 | |
| C. | 因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定 | |
| D. | 所有原子轨道在空间中都有自己的方向性 |
10.某学生做完实验后,采用以下方法清洗所用仪器:①用稀硝酸清洗做过银镜反应的试管;②用酒精清洗做过碘升华实验的试管;③用NaOH溶液清洗盛过苯酚的试管;④用NaOH溶液清洗做过植物油和溴水反应的试管,你认为他的操作( )
| A. | ②不对 | B. | ③④不对 | C. | ①④不对 | D. | 全部正确 |
17.将适量金属钠投入下列物质的溶液中,有气体放出,但无沉淀生成的是( )
| A. | HCl | B. | Ca(HCO3)2溶液 | C. | FeCl3 | D. | CuSO4 |
15.在100kPa和298K时,有关反应的热化学方程式有:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为-285.8 kJ•mol-1 | |
| D. | O2前面的表示参加反应的O2的分子数目 |
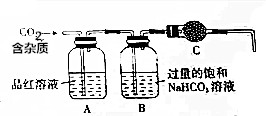 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题: