题目内容
14.把煤作为燃料可通过下列两种途径获得热量:途径Ⅰ:直接燃烧:C(s)+O2 (g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g) (放热Q1kJ)
途径Ⅱ:先制成水煤气,再燃烧水煤气:
C(s)+H2O(g)═CO(g)+H2(g) (吸热Q2kJ)
2CO(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)
2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(g)(共放热Q3kJ)
(1)判断途径Ⅰ放出的总热量等于(填“大于”“小于”或“等于”)途径Ⅱ放出的总热量.
(2)在制水煤气的反应中,反应物所具有的总能量小于(填“大于”“小于”或“等于”)生成物所具有的总能量,因此在反应时,反应物就需要吸收能量才能转化为生成物,其反应的条件为高温.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知:
C(s,石墨)+O2 (g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变为:△H=+226.7kJ•mol-1.
分析 (1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;
(2)当反应物的能量低于生成物的能量时,反应是吸热的;
(3)依据热化学方程式和盖斯定律计算得到.
解答 解:(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,
故答案为:等于;
(2)制水煤气 C(s)+H2O(g)=CO(g)+H2(g)△H2>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,反应物就需要吸收能量才能转化为生成物,反应条件是高温,
故答案为:小于;吸收;高温;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+453.4kJ•mol-1;
热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查反应热与焓变的应用,题目难度中等,理解盖斯定律是解题的关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.对下列选项中的操作和现象,其解释与结论完全正确的是( )
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO32->HCO3- |
| D | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 原Fe(NO3)2样品溶于酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
1.结构为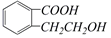 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①
②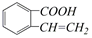
③
④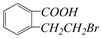
生成这四种有机物的反应类型依次为( )
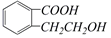 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:①

②

③

④
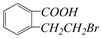
生成这四种有机物的反应类型依次为( )
| A. | 取代、消去、酯化、加成 | B. | 取代、消去、加聚、取代 | ||
| C. | 酯化、取代、缩聚、取代 | D. | 酯化、消去、氧化、取代 |
2. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
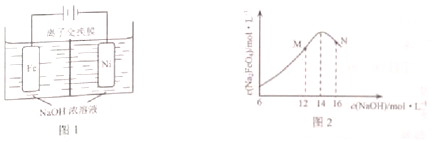
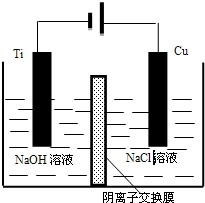
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
6.化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如图:
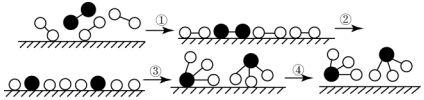
下列关于合成氨反应的叙述中不正确的是( )

下列关于合成氨反应的叙述中不正确的是( )
| A. | 该过程表明,在化学反应中存在化学键的断裂与形成 | |
| B. | 在催化剂的作用下,反应物的化学键变得容易断裂 | |
| C. | 过程②需吸收能量,过程③则放出能量 | |
| D. | 常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
3.(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
4.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |