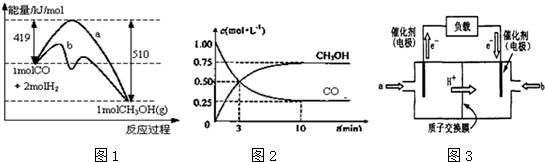
题目内容
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已经潮解 |
| B、定容时仰视刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、称量时所用砝码生锈 |
考点:溶液的配制
专题:
分析:根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
| n |
| V |
解答:
解:A、氢氧化钠已潮解,会导致真正的氢氧化钠的质量偏低,则浓度偏低,故A不选;
B、定容时仰视刻度线,则溶液体积偏大,则浓度偏低,故B不选;
C、有少量的氢氧化钠溶液残留,则溶质损失,导致溶液的浓度偏低,故C不选;
D、称量药品时,m物=m砝+m游,称量时所用砝码生锈,故物品的质量偏大,则浓度偏高,故D选.
故选D.
B、定容时仰视刻度线,则溶液体积偏大,则浓度偏低,故B不选;
C、有少量的氢氧化钠溶液残留,则溶质损失,导致溶液的浓度偏低,故C不选;
D、称量药品时,m物=m砝+m游,称量时所用砝码生锈,故物品的质量偏大,则浓度偏高,故D选.
故选D.
点评:本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
取等体积0.05mol?L-1的Ba(OH)2溶液,分别装入标有①②③④编号的4个锥形瓶中,将①加水稀释到原体积的2倍,在②③中分别通入少量的CO2;④作对照,分别在①②中滴加酚酞做指示剂(pH变色范围:0-8-10-14);在③④中滴加甲基橙做指示剂(PH变色范围0-3.1-4.4-14),用HCl溶液分别摘定上述4种溶液,所消耗HCl溶液的体积是( )
| A、②<①<③=④ |
| B、①=②=③=④ |
| C、①<②<③<④ |
| D、②<③<①<④ |
月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法不正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)2XY3(g)△H=-92.6kJ.mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述错误的是( )
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
A、平衡时,容器②中X2的体积分数为
| ||
| B、平衡时,两个容器中XY3的物质的量浓度相等 | ||
C、容器①、②中反应的平衡常数相等,K=
| ||
| D、容器①体积为0.3L,则达平衡时放出的热量小于46.3kJ |
如图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.下列说法正确的是( )
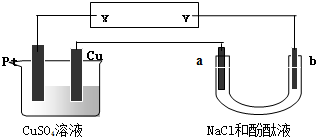

| A、NaCl溶液浓度不变 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液浓度变小 |
| D、X是正极,Y是负极 |