题目内容
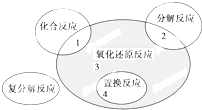
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是( )

| A、Cl2+2NaI═2NaCl+I2 | ||||
B、NH4HCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、Fe2O3+3CO
|
考点:氧化还原反应
专题:氧化还原反应专题
分析:属于阴影部分的反应为不属于化合反应、分解反应和置换反应的氧化还原反应,该反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答:
解:A.该反应中Cl元素化合价由0价变为-1价、I元素化合价由-1价变为0价,所以属于氧化还原反应但还属于置换反应,故A不选;
B.该反应中没有元素化合价变化,且属于分解反应,故B不选;
C.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,所以氧化还原反应但还属于分解反应,故C不选;
D.该反应中Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,且该反应不属于化合反应、置换反应或分解反应,故D选;
故选D.
B.该反应中没有元素化合价变化,且属于分解反应,故B不选;
C.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由0价变为-2价,所以氧化还原反应但还属于分解反应,故C不选;
D.该反应中Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,且该反应不属于化合反应、置换反应或分解反应,故D选;
故选D.
点评:本题考查基本反应类型及氧化还原反应,侧重考查基本概念,根据元素化合价变化及基本反应类型概念解答即可,注意常见元素化合价.

练习册系列答案
相关题目
下列曲线图与对应选项不正确的是( )

| A、向1L浓度均为0.1mol?L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol?L-1稀H2SO4溶液 |
| B、向含有0.1 mol?L-1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1 mol?L-1NaOH溶液 |
| C、向烧碱溶液中逐滴加入明矾溶液 |
| D、向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H=a kJ?mol-1
其化学平衡常数K和温度T的关系如下表所示:则下列有关叙述正确的是( )
其化学平衡常数K和温度T的关系如下表所示:则下列有关叙述正确的是( )
| T(℃) | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、a<0 |
| B、可测量容器总压变化来判定化学反应是否达到平衡 |
| C、温度为830℃时,若c(CO2)?c(H2)>c(CO)?c(H2O),此时v正>v逆 |
| D、温度不变,增大c(CO2),平衡右移,K增大 |
把0.05molNaOH晶体分别加入到下列100mL液体中,溶液导电性变化最大的是( )
| A、0.5mol?L-1NH4Cl |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1H2SO4 |
| D、0.5mol?L-1Cu(NO3)2 |
下列说法正确的是( )
| A、稀硫酸、氨水均为电解质 |
| B、漂粉精、液氯、干冰均为混合物 |
| C、由于HF分子间存在氢键,因此HF比HCl稳定 |
| D、16O和18O互为同位素 |
某条件下,锌与稀硝酸反应,其物质的量之比为5:12,则此时硝酸的还原产物是( )
| A、NO2 |
| B、N2O |
| C、N2 |
| D、NH4NO3 |
下列说法正确的是( )
| A、P的非金属性比N强,对应的单质白磷比氮气活泼 |
| B、工业上通常用电解Na、Fe、Cu对应的氯化物制得该三种金属单质 |
| C、氨易液化、硫化氢在同族元素的氢化物中熔沸点最低可用同一原理解释 |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、25℃1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、0℃101千帕,11.2L氮气所含的原子数目为NA |
| D、17g氨气所含电子数目为10NA |
