题目内容
在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H=a kJ?mol-1
其化学平衡常数K和温度T的关系如下表所示:则下列有关叙述正确的是( )
其化学平衡常数K和温度T的关系如下表所示:则下列有关叙述正确的是( )
| T(℃) | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、a<0 |
| B、可测量容器总压变化来判定化学反应是否达到平衡 |
| C、温度为830℃时,若c(CO2)?c(H2)>c(CO)?c(H2O),此时v正>v逆 |
| D、温度不变,增大c(CO2),平衡右移,K增大 |
考点:化学平衡常数的含义,化学平衡状态的判断
专题:
分析:A、依据平衡常数随温度变化结合化学平衡移动原理分析判断反应的能量变化;
B、反应前后是气体体积不变的反应,恒容容器中改变压强不改变化学平衡;
C、温度为830℃时K=1,c(CO2)?c(H2)>c(CO)?c(H2O),平衡正向进行;
D、平衡常数是温度的函数;
B、反应前后是气体体积不变的反应,恒容容器中改变压强不改变化学平衡;
C、温度为830℃时K=1,c(CO2)?c(H2)>c(CO)?c(H2O),平衡正向进行;
D、平衡常数是温度的函数;
解答:
解:A、平衡常数随温度变化可知,温度越高平衡常数越大,平衡正向进行,结合化学平衡移动原理分析,正反应是吸热反应,a>0,故A错误;
B、CO2(g)+H2(g)?CO(g)+H2O(g),反应前后是气体体积不变的反应,恒容容器中改变压强不改变化学平衡,不能测量容器总压变化来判定化学反应是否达到平衡,故B错误;
C、温度为830℃时K=1,c(CO2)?c(H2)>c(CO)?c(H2O),平衡正向进行,此时v正>v逆,故C正确;
D、温度不变,K不变,故D错误;
故选C.
B、CO2(g)+H2(g)?CO(g)+H2O(g),反应前后是气体体积不变的反应,恒容容器中改变压强不改变化学平衡,不能测量容器总压变化来判定化学反应是否达到平衡,故B错误;
C、温度为830℃时K=1,c(CO2)?c(H2)>c(CO)?c(H2O),平衡正向进行,此时v正>v逆,故C正确;
D、温度不变,K不变,故D错误;
故选C.
点评:本题考查了化学平衡常数、化学平衡的影响因素分析,掌握平衡移动原理和反应特征分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某干燥粉末可能由Na2O.Na2O2.Na2CO3.NaHCO3.NaCl中的一种或几种组成.将该粉末与足量盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定).若将原来的粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A、粉末中一定有Na2O,Na2O2,NaHCO3 |
| B、无法确定是否含有NaHCO3 |
| C、粉末中一定不含有Na2O和NaCl |
| D、无法确定是否含有Na2CO3和NaCl |
化学与社会、生产、生活紧切相关,下列说法正确的是( )
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用;
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较高,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和纯碱.
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用;
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较高,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和纯碱.
| A、①②④⑤ | B、①②④⑥ |
| C、②④⑤ | D、②④⑥ |
向溴化钠、碘化钾的混合溶液中通入过量氯气充分反应,将溶液蒸干,并灼烧所得物质,最后残留的固体物质是( )
| A、NaCl和KCl |
| B、NaCl和KCl和I2 |
| C、NaCl和KI |
| D、NaBr和KCl |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是
( )

( )

| A、图a是其它条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、图b是在有无催化剂存在下建立的平衡过程图象,曲线a是使用催化剂的曲线 |
| C、图c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
| D、图d是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
与100mL,2mol/L的AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A、3 mL 2 mol/L的NaCl溶液 |
| B、50 mL 4 mol/L的FeCl3溶液 |
| C、200 mL 1mol/L的HCl溶液 |
| D、50 mL 3 mol/L的BaCl2溶液 |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是( )
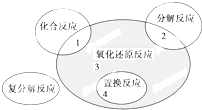

| A、Cl2+2NaI═2NaCl+I2 | ||||
B、NH4HCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、Fe2O3+3CO
|
关于“物质的量”叙述正确的是( )
| A、单位:g.mol-1 |
| B、七个基本物理量之一 |
| C、用来描述微观粒子的质量 |
| D、数值是:6.02×1023 |