题目内容
下列曲线图与对应选项不正确的是( )

| A、向1L浓度均为0.1mol?L-1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol?L-1稀H2SO4溶液 |
| B、向含有0.1 mol?L-1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1 mol?L-1NaOH溶液 |
| C、向烧碱溶液中逐滴加入明矾溶液 |
| D、向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:图示题
分析:A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,然后是硫酸和NaAlO2发生反应的过程;
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程;
C、向烧碱溶液中加明矾,开始阶段烧碱溶液过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程;
D、Ba(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失.
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程;
C、向烧碱溶液中加明矾,开始阶段烧碱溶液过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程;
D、Ba(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失.
解答:
解:A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,所以反应开始就有沉淀生成,然后是硫酸和NaAlO2发生反应的过程,当加入2.5L硫酸,沉淀氢氧化铝全部溶解,故A错误;
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程,消耗NaOH的量之比是3:3:1,故B正确;
C、向烧碱溶液中加明矾,开始阶段烧碱溶液过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程,故C正确;
D、Ba(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失,两个过程消耗的二氧化碳的量相等,故D正确.
故选A.
B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程,消耗NaOH的量之比是3:3:1,故B正确;
C、向烧碱溶液中加明矾,开始阶段烧碱溶液过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程,故C正确;
D、Ba(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失,两个过程消耗的二氧化碳的量相等,故D正确.
故选A.
点评:本题考查学生物质的性质以及化学反应发生的先后知识,结合图象来考查,增加了题目的难度.

练习册系列答案
相关题目
下列物质既能跟NaOH溶液作用,又能跟盐酸反应的是( )
| A、NaHCO3 |
| B、Al2O3 |
| C、NaHSO4 |
| D、AlCl3 |
某干燥粉末可能由Na2O.Na2O2.Na2CO3.NaHCO3.NaCl中的一种或几种组成.将该粉末与足量盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定).若将原来的粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A、粉末中一定有Na2O,Na2O2,NaHCO3 |
| B、无法确定是否含有NaHCO3 |
| C、粉末中一定不含有Na2O和NaCl |
| D、无法确定是否含有Na2CO3和NaCl |
在可逆反应:2A+3B?2C,改变下列条件一定能加快反应速率的是( )
| A、增大反应物的量 |
| B、升高温度 |
| C、增大压强 |
| D、减小生成物的量 |
认识反应条件对化学反应的影响,对学好化学具有重要意义.下列说法中正确的是( )
| A、镁在空气中或纯净氧气中燃烧的产物都只有MgO |
| B、钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 |
| C、向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 |
| D、氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |
化学与社会、生产、生活紧切相关,下列说法正确的是( )
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用;
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较高,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和纯碱.
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用;
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较高,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和纯碱.
| A、①②④⑤ | B、①②④⑥ |
| C、②④⑤ | D、②④⑥ |
向溴化钠、碘化钾的混合溶液中通入过量氯气充分反应,将溶液蒸干,并灼烧所得物质,最后残留的固体物质是( )
| A、NaCl和KCl |
| B、NaCl和KCl和I2 |
| C、NaCl和KI |
| D、NaBr和KCl |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影3区域的是( )
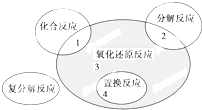

| A、Cl2+2NaI═2NaCl+I2 | ||||
B、NH4HCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、Fe2O3+3CO
|


