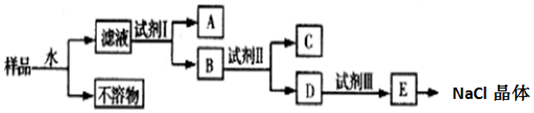
题目内容
17.以稀盐酸为电解质溶液,铁、铜为原电池的两极,问题:(1)铁为负极,电极反应式为Fe-2e-=Fe2+发生氧化反应;
(2)铜为正极,电极反应式为2H++2e-=H2↑发生还原反应;
(3)该反应总反应式Fe+2H+=Fe2++H2↑(写离子方程式)
(4)指出电子的流动方向负极沿导线流向正极
(5)(选讲题)若消耗了5.6g的铁,则可以产生标况下的氢气2.24L.
分析 铜铁原电池中,较为活泼的金属铁为原电池的负极,发生氧化反应,正极为较不活泼的铜,发生还原反应,根据金属的性质和电解质溶液书写电极反应式.
解答 解:(1)铁为负极,发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故答案为:铁;Fe-2e-=Fe2+;氧化;
(2)不活泼的铜为正极,电解质溶液中的氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,故答案为:铜;2H++2e-=H2↑;还原;
(3)该反应总反应式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)原电池中电子由负极沿导线流向正极,故答案为:负极沿导线流向正极;
(5)根据总反应式为Fe+2H+=Fe2++H2↑,消耗56g的铁生成标况下的氢气22.4L,所以消耗了5.6g的铁,则可以产生标况下的氢气2.24L,故答案为:2.24L.
点评 本题考查原电池的工作原理,题目难度不大,注意正负极的判断和电极反应式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 16g由O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA | |
| C. | 100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA | |
| D. | 标准状况下,22.4LSO3含有的分子数为NA个 |
3.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性:CH3COOH>H2CO3 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1NaHCO3溶液等体积混合:3[c(CO32-)+c(HCO3-)+c(H2CO3)]=2c(Na+) |
8.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂,氧化产物、还原产物都是N2 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
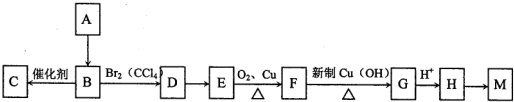
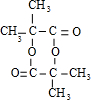 .
.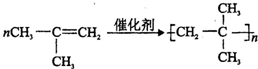 ;E→F
;E→F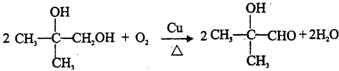 .
.