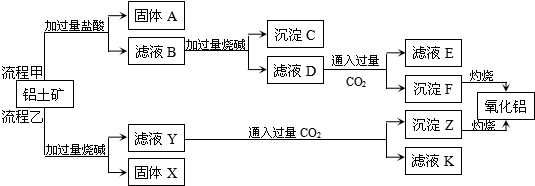
题目内容
6.下列说法正确的是( )| A. | 熔点:Na-K合金<Na<氯化钠 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
分析 A.根据熔点:原子晶体>离子晶体>金属晶体进行判断;
B.元素的非金属性越强,对应的氢化物越稳定;
C.二氧化硫具有还原性,过氧化钠具有氧化性,据此解答;
D.无论是哪个能层数上的能级,p能级有3个原子轨道.
解答 解:A.原子晶体>离子晶体>金属晶体,而合金的熔点小于组成金属的熔点,则有熔点:Na-K合金<Na<氯化钠,故A正确;
B.因非金属性O>S>Se,Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,则非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl>H2S>PH3,故B错误;
C.二氧化硫与过氧化钠反应能生成硫酸钠,故C错误;
D.无论是哪个能层数上的能级,只要是s能级就有1个原子轨道,p能级有3个原子轨道,d能级有5个原子轨道,f能级有7个原子轨道,所以2p、3p、4p能级的轨道数都为3,故D错误,
故选A.
点评 本题综合考查晶体的熔点比较、元素周期律和金属的堆积模型等知识,侧重于学生的分析能力和综合运用化学知识的能力,能较好地培养学生的科学素养,为高考常见题型,学习中注意相关基础知识的积累,难度不大

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
16.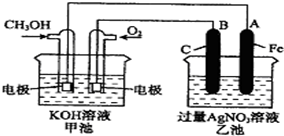 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )| A. | 甲池是燃料电池,其中通入氧气的一极是原电池的正极 | |
| B. | 乙池是电解池,铁电极是阴极,一段时间后会析出金属银 | |
| C. | 甲池是电解池,乙是原电池 | |
| D. | 甲池一段时间后溶液的pH值会变小 |
14.下列有关试剂的保存方法错误的是( )
| A. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氟酸盛装在细口玻璃瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
1.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
| A. | Na2CO3和NaHCO3均可与HCl反应 | |
| B. | Na2CO3能与石灰水反应而NaHCO3不能 | |
| C. | Na2CO3的热稳定性比NaHCO3的强 | |
| D. | Na2CO3比NaHCO3易溶于水 |
11.下列物质与用途不相对应的是( )
| A. | Na2O2--潜水艇中作供氧剂 | B. | SiO2--半导体材料 | ||
| C. | Al(OH)3--胃酸中和剂 | D. | Ca(ClO)2--消毒剂 |
18.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2L 0.5mol/L亚硫酸溶液中含有的H+两种数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
13.农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜起反应.在该反应中,铁( )
| A. | 是氧化剂 | B. | 是还原剂 | C. | 得到电子 | D. | 被还原 |
 如图是实验室制取氨气的装置图,请回答:
如图是实验室制取氨气的装置图,请回答: