题目内容
12.根据图回答问题: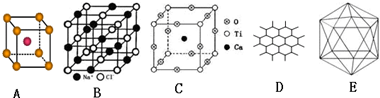
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是1:1.
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+和Cl-的个数分别为4、4.
(3)钇钡铜复合氧化物超导体有着与钙钛矿型相关的晶体结构,若Ca、Ti、O结构如C图所示的晶体,其化学式为CaTiO3.
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为2,C-C键个数为3.
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如E图所示.其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子.试观察E图,推断这个基本结构单元所含硼原子个数、键角、B-B键的个数依次为12、60°、30.
分析 (1)利用均摊法计算晶胞中阴阳离子个数;
(2)利用均摊法计算每个晶胞中含有的氯离子和钠离子个数;
(3)利用均摊法计算晶胞中Ti4+、Ca2+、O2-数目,确定比例关系书写化学式;
(4)利用均摊法计算碳原子数和碳碳键数目;
(5)根据晶体硼的基本结构单元图可知,基本结构单元中含有20个正三角形,键角60°,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为$\frac{20×3}{5}$=12,每个B-B键被两个三角形共用,所以B-B键为:$\frac{20×3}{2}$=30;据此答题.
解答 解:(1)A图晶胞中阳离子个数为1,阴离子个数=8×$\frac{1}{8}$=1,所以该晶胞中阳离子、阴离子个数之比=1:1;
故答案为:1:1;
(2)该晶胞中钠离子个数=1+12×$\frac{1}{4}$=4,氯离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4;
故答案为:4,4;
(3)由结构可知,Ca2+位于体心有1个,Ti4+位于顶点,数目为8×$\frac{1}{8}$=1个,O2-位于棱心,数目为12×$\frac{1}{4}$=3个,故其化学式为CaTiO3,
故答案为:CaTiO3;
(4)每个碳原子被三个碳环共有,每个碳环含有碳原子数为:6×$\frac{1}{3}$=2,每条C-C键被两个碳环共有,每个碳环含有碳碳键6×$\frac{1}{2}$=3条;
故答案为:2:3;
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,基本结构单元中含有20个正三角形,键角60°,每个顶角各有一个原子,每个顶点被5个正三角形共用,所以基本结构单元中含有硼原子个数为$\frac{20×3}{5}$=12,每个B-B键被两个三角形共用,所以B-B键为:$\frac{20×3}{2}$=30;
故答案为:12;60°;30.
点评 本题主要考查了晶胞的计算、晶体的结构等知识,解决此题应具备一定的处理信息和空间想象能力,题目难度中等.

| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 1molOH-的质量是17g | |
| D. | 1mol气体所占的体积约为22.4L |
| A. | 石油裂解气和水煤气的主要成分都是甲烷 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 化石燃料所存贮的大量能量,实质是来源于太阳能 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 向醋酸溶液中加水可使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 |
( )
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | M分别和w、X、Y、Z形成化合物,均显相同化合价 | |
| C. | M、X、Z三种元素组成的化合物含有离子键 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
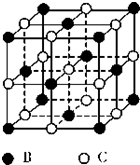 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元 素在地壳中含量居第四位;则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30).A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元 素在地壳中含量居第四位;则: 有机物A的结构简式为
有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
 可以发生消去反应
可以发生消去反应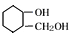 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.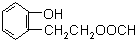 和
和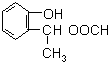 (不考虑立体异构).
(不考虑立体异构). .
.