题目内容
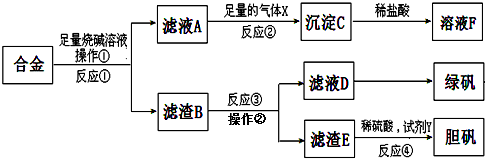
I.现取一定量含有Na2O杂质的Na2O2试样进行纯度分析.请按要求回答问题:测定Na2O2纯度的方法很多:(1)重量法---将样品溶于盐酸,蒸发后测NaCl的质量.所得NaCl质量越高,样品中杂质的含量越 (选填“高“或“低“).
(2)气体体积法--测量样品溶于水后释放的O2的体积.若样品为a g,所测O2体积折算为标准状况为b L,则样品中Na2O2的质量分数为 (用含a、b的式子表示).
(3)有同学计划采用“氧化还原滴定法“--将样品溶于水后,用标准酸性高锰酸钾溶液滴定(紫红色MnO4-被还原为接近无色的Mn 2+ ).其实这种计划很难实现,因为.
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在 离子.
Ⅱ.“滴定法”是化学分析的常用方法.每次使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液一般是 .某工业废水中含有少量Ag+,现欲通过“滴定法“测定其浓度:已知:①K2CrO4(铬酸钾)是一种可溶性盐;②Ag2CrO4是一种呈砖红色的难溶性盐,但它的溶解度略高于AgCl(即AgCl比Ag2CrO4更难溶);③废水中的其它金属离子不与CrO4 2-、Cl-发生反应.实验室提供的试剂有:(a)标准AgNO3溶液、(b)标准NaCl溶液、(c)5% K2CrO4溶液.提供的定量仪器只有滴定管.
请将下列实验步骤填写完全:
(1)量取一定体积的含银废水置于 瓶中.
(2)在废水样品中加入过量的 ,并振荡摇匀.
(3)再滴入少量c作为滴定终点指示剂.
(4)用 溶液滴定,直至 色出现即刻停止.
(5)重复以上实验,根据记录的数据计算测定结果.
(6)以上(1)~(5)步操作中必须使用滴定管的步骤是 (填编号).
(2)气体体积法--测量样品溶于水后释放的O2的体积.若样品为a g,所测O2体积折算为标准状况为b L,则样品中Na2O2的质量分数为
(3)有同学计划采用“氧化还原滴定法“--将样品溶于水后,用标准酸性高锰酸钾溶液滴定(紫红色MnO4-被还原为接近无色的Mn 2+ ).其实这种计划很难实现,因为.
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在
Ⅱ.“滴定法”是化学分析的常用方法.每次使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液一般是
请将下列实验步骤填写完全:
(1)量取一定体积的含银废水置于
(2)在废水样品中加入过量的
(3)再滴入少量c作为滴定终点指示剂.
(4)用
(5)重复以上实验,根据记录的数据计算测定结果.
(6)以上(1)~(5)步操作中必须使用滴定管的步骤是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、(1)氧化钠中钠元素的含量高于过氧化钠,故氯化钠的质量越高,说明样品中钠元素的质量越大,样品中杂质氧化钠的含量越高;
(2)发生反应:2Na2O2+2H2O=4NaOH+O2↑,根据方程式计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(3)Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应,反应很难实现;
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在过氧根原子团;
Ⅱ、使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液应为 先蒸馏水洗涤,再待装溶液润洗;
本题运用沉淀滴定法来进行的定量实验,其原理和中和滴定非常相似.在一定量的少量Ag+的工业废水中,加一定量(过量)的标准NaCl溶液,再用标准AgNO3溶液把与废水中的银离子反应后剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度.依据的反应是Ag++Cl-=AgCl↓,在这个沉淀滴定中运用铬酸钾做指示剂.
(2)发生反应:2Na2O2+2H2O=4NaOH+O2↑,根据方程式计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(3)Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应,反应很难实现;
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在过氧根原子团;
Ⅱ、使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液应为 先蒸馏水洗涤,再待装溶液润洗;
本题运用沉淀滴定法来进行的定量实验,其原理和中和滴定非常相似.在一定量的少量Ag+的工业废水中,加一定量(过量)的标准NaCl溶液,再用标准AgNO3溶液把与废水中的银离子反应后剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度.依据的反应是Ag++Cl-=AgCl↓,在这个沉淀滴定中运用铬酸钾做指示剂.
解答:
Ⅰ.解:(1)氧化钠中钠元素的含量高于过氧化钠,故氯化钠的质量越高,说明样品中钠元素的质量越大,样品中杂质氧化钠的含量越高,故答案为:高;
(2)设样品中过氧化钠的质量为m g,则:
2Na2O2+2H2O=4NaOH+O2↑,
2×78g 22.4L
m g b L
2×78 g:m g=22.4L:b L
解得m=
样品中过氧化钠的质量分数=
×100%=
×100%,
故答案为:
×100%;
(3)Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应,反应很难实现,
故答案为:Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应.
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在过氧根原子团,O22-;
故答案为:O22-;
Ⅱ.使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液应为 先蒸馏水洗涤,再待装溶液润洗;
故答案为:蒸馏水和待装液(或标准液);
(1)由于废水里要先加过量的标准NaCl溶液,充分反就后再滴定所以必须将待测液置于锥形瓶中,因为滴定管有能作为反应容器;
故答案为:锥形瓶;
(2)在废水先加入过量的已知体积的标准NaCl溶液b,使银离子完全沉淀,再用标准AgNO3溶液把剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度,故答案为:b;
(4)在废水先加入过量的已知体积的标准NaCl溶液,使银离子完全沉淀,剩余的氯离子需要用a标准AgNO3溶液把它滴定出来,由于Ag2CrO4是一种呈砖红色的难溶性盐且AgCl比Ag2CrO4更难溶,所以可以选5% K2CrO4溶液为指示剂;
故答案为:a;砖红;
(6)在整个实验过程中含银废水、过量的标准NaCl溶液、标准AgNO3溶液都要精确量取体积,然后才能计算出废水中含Ag+的浓度,在重复实验的时候也需要这样做,故答案为:(1)(2)(4)(5).
(2)设样品中过氧化钠的质量为m g,则:
2Na2O2+2H2O=4NaOH+O2↑,
2×78g 22.4L
m g b L
2×78 g:m g=22.4L:b L
解得m=
| 156b |
| 22.4 |
样品中过氧化钠的质量分数=
| ||
| ag |
| 156b |
| 22.4a |
故答案为:
| 156b |
| 22.4a |
(3)Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应,反应很难实现,
故答案为:Na2O2溶于水后已迅速释放O2,发生自身氧化还原反应.
(4)离子晶体的化学式多用最简式表示,但Na2O2不表示为NaO,因为该晶体中存在过氧根原子团,O22-;
故答案为:O22-;
Ⅱ.使用滴定管均需对其进行洗涤.若滴定管内壁没有难溶物附着,所用的洗涤液应为 先蒸馏水洗涤,再待装溶液润洗;
故答案为:蒸馏水和待装液(或标准液);
(1)由于废水里要先加过量的标准NaCl溶液,充分反就后再滴定所以必须将待测液置于锥形瓶中,因为滴定管有能作为反应容器;
故答案为:锥形瓶;
(2)在废水先加入过量的已知体积的标准NaCl溶液b,使银离子完全沉淀,再用标准AgNO3溶液把剩余的氯离子滴定出来,这样就可以计算出废水中银离子的浓度,故答案为:b;
(4)在废水先加入过量的已知体积的标准NaCl溶液,使银离子完全沉淀,剩余的氯离子需要用a标准AgNO3溶液把它滴定出来,由于Ag2CrO4是一种呈砖红色的难溶性盐且AgCl比Ag2CrO4更难溶,所以可以选5% K2CrO4溶液为指示剂;
故答案为:a;砖红;
(6)在整个实验过程中含银废水、过量的标准NaCl溶液、标准AgNO3溶液都要精确量取体积,然后才能计算出废水中含Ag+的浓度,在重复实验的时候也需要这样做,故答案为:(1)(2)(4)(5).
点评:本题考查物质含量的测定、化学方程式的有关计算,明确原理是关键,侧重对学生基础知识的巩固和训练,同时也有利于提高学生灵活运用基础知识解决实际问题的能力,难度中等.

练习册系列答案
相关题目
下列实验操作,现象或装置正确的是( )
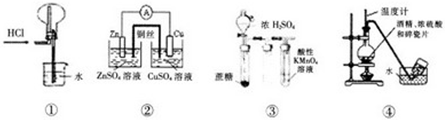

| A、实验①,氯化氢气体的吸收 |
| B、实验②,铜锌原电池 |
| C、实验③:酸性KMnO4溶液中出现气泡,且颜色不变 |
| D、实验④:实验室制取收集乙烯 |
下列各示意图与对应的表述正确的是( )
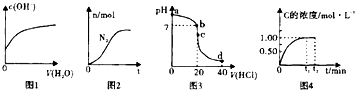

| A、图1表示亚硫酸氢钠溶液加水稀释时,溶液中c(OH-)的变化[已知亚硫酸氢钠溶液c(SO32-)>c(H2SO3)] |
| B、图2表示某离子反应中涉及Cl-,H+,N2,ClO-,NH4-,H2O六种微粒,其中N2的物质的量随时间变化的曲线,反应后溶液的酸性明显减弱 |
| C、图3表示室温下,将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线,d点所示溶中离子浓度由大到小的排序是c(Cl+)>c(NH4+)>c(H+)>c(OH+) |
| D、图4表示均为1molA,B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),C的浓度随时间变化的曲线,则x=2 |
 (1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ/mol.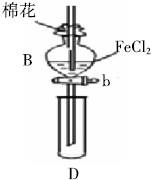 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下: