题目内容
 (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB-(少量)=A-+H2B ②H2B(少量)+C-=HB-+HC③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则HA酸对应的电离常数Ka=
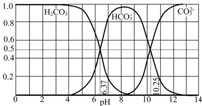
(2)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.①下列叙述正确的是
A.此图是1.0mol?L-1碳酸钠溶液滴定1.0mol?L-1HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10mL 0.02mol?L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100mL,向该溶液中加入1mL 1×10-4 mol?L-1的CaCl2溶液,问是否有沉淀生成?
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)强酸能和弱酸的盐反应生成弱酸,相同温度下,酸的电离平衡常数越大,其酸性越强;
(2)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,浓度应逐渐增大,且起始浓度不可能为1.0mol/L;
B.pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-);
C.pH为7.4时,HCO3-的最大;
D.在PH为7~9时,溶液中多以HCO3-形式存在;
②如果KSP(BaCO3)=c(Ba2+)?c(CO32-)大于Qc,则该溶液中没有沉淀产生.
(2)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,浓度应逐渐增大,且起始浓度不可能为1.0mol/L;
B.pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-);
C.pH为7.4时,HCO3-的最大;
D.在PH为7~9时,溶液中多以HCO3-形式存在;
②如果KSP(BaCO3)=c(Ba2+)?c(CO32-)大于Qc,则该溶液中没有沉淀产生.
解答:
解:(1)根据溶液中强酸制弱酸的原理以及反应H2B(少量)+C-=HB-+HC,可以确定酸性强弱是:H2B>HC>HB-,根据HA+HB-(少量)=A-+H2B知,酸性HA>H2B,所以这几种酸的酸性强弱顺序是HA>H2B>HC>HB-,
若H2B的Ka1=4.3×10-7,则HA的Ka=1.8×10-5;
故答案为:1.8×10-5;
(2)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;
C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;
D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;
故答案为:CD;
②在10mL0.02mol/LNa2CO3溶液中加入某浓度的盐酸后,当调节溶液的pH=10.25时,据图中内容可以看出:HCO3-、CO32-两种成分平衡时的组成分数分别为50%,即碳酸钠和碳酸氢钠的物质的量分别是0.0001mol,此时溶液的体积恰好为100mL,所碳酸钠中碳酸根的浓度是0.001mol/L,再加入1mL1×10-4mol?L-1的CaCl2稀溶液时,Qc=c(Ba2+)?c(CO32-)=0.001mol/L×10-6mol/L=1×10-9(mol/L)2,而Ksp(CaCO3)=5.0×10-9,Qc<Ksp,所以不能生成沉淀,
故答案为:否.
若H2B的Ka1=4.3×10-7,则HA的Ka=1.8×10-5;
故答案为:1.8×10-5;
(2)①A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;
C.由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;
D.溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;
故答案为:CD;
②在10mL0.02mol/LNa2CO3溶液中加入某浓度的盐酸后,当调节溶液的pH=10.25时,据图中内容可以看出:HCO3-、CO32-两种成分平衡时的组成分数分别为50%,即碳酸钠和碳酸氢钠的物质的量分别是0.0001mol,此时溶液的体积恰好为100mL,所碳酸钠中碳酸根的浓度是0.001mol/L,再加入1mL1×10-4mol?L-1的CaCl2稀溶液时,Qc=c(Ba2+)?c(CO32-)=0.001mol/L×10-6mol/L=1×10-9(mol/L)2,而Ksp(CaCO3)=5.0×10-9,Qc<Ksp,所以不能生成沉淀,
故答案为:否.
点评:本题考查弱酸的电离平衡常数与酸的酸性强弱的关系、难溶物的溶解平衡及学生的识图和应用的能力,明确图象中pH与离子的浓度关系是解答本题的关键,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各示意图与对应的表述正确的是( )
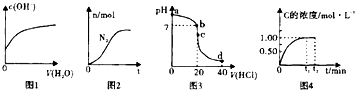

| A、图1表示亚硫酸氢钠溶液加水稀释时,溶液中c(OH-)的变化[已知亚硫酸氢钠溶液c(SO32-)>c(H2SO3)] |
| B、图2表示某离子反应中涉及Cl-,H+,N2,ClO-,NH4-,H2O六种微粒,其中N2的物质的量随时间变化的曲线,反应后溶液的酸性明显减弱 |
| C、图3表示室温下,将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线,d点所示溶中离子浓度由大到小的排序是c(Cl+)>c(NH4+)>c(H+)>c(OH+) |
| D、图4表示均为1molA,B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),C的浓度随时间变化的曲线,则x=2 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入1.60g CuO,恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为( )
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
有关化学化学平衡状态的特征,下列说法正确的是( )
| A、所有的化学反应都存在化学平衡状态 |
| B、平衡时反应已经达到最大限度,反应停止了 |
| C、平衡时各组分的浓度相等 |
| D、化学平衡状态是一种动态平衡 |
将NaClO3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaClO3和NaI恰好完全反应,生成 I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为( )
| A、Cl2 |
| B、Cl2O |
| C、Cl2O3 |
| D、ClO2 |
下列离子不会对水体造成污染的是( )
| A、Ba2+ |
| B、Cl- |
| C、Cu2+ |
| D、Pb2+ |
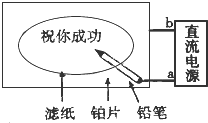 某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列
某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列