题目内容
16.有下列四种含苯环的有机物,用序号填空①
 ②
② ③
③ ④TNT
④TNT属于苯的同系物的是①,属于芳香烃的是①②,属于芳香化合物的是①②③④.
分析 (1)苯的同系物中一定含有且只含有一个苯环,其它结构一定为饱和结构且不能成环;
(2)仅有C、H两种元素组成的含有苯环的化合物属于芳香烃;
(3)碳环化合物中含有苯环结构的化合物称为芳香化合物.
解答 解:(1)①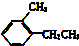 中含有1个苯环,只含有CH两种元素,且支链为烷基,属于苯的同系物,故答案为:①;
中含有1个苯环,只含有CH两种元素,且支链为烷基,属于苯的同系物,故答案为:①;
(2)① ②
② 含有苯环,且只含有CH两种元素,属于芳香烃,故答案为:①②;
含有苯环,且只含有CH两种元素,属于芳香烃,故答案为:①②;
(3)① ②
② ③
③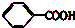 ④TNT中含有苯环,属于芳香化合物,故答案为:①②③④.
④TNT中含有苯环,属于芳香化合物,故答案为:①②③④.
点评 本题主要考查了有机物的分类,难度中等,注意通过结构特点对有机化学基础中相似概念的辨析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各项比较错误的是( )
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
11.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
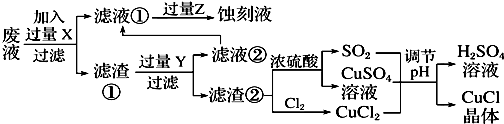
根据以上信息回答下列问题:
(1)写出生产过程中XFe,YHCl.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低的原因是pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小.
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.
三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)写出生产过程中XFe,YHCl.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.
三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
8.下列各组化合物的性质比较,不正确的是( )
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
5.可逆反应H2(g)+I2(g)═2HI(g)达到平衡时的标志是( )
| A. | 混合气体密度恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | H2、I2、HI在混合气体中体积分数相等 |
6.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 1molP4含有P-P键的个数为4NA | |
| B. | 1 mol Na2O2晶体中含有阴阳离子总数为4NA | |
| C. | 1mol金刚石中含有C-C键的个数为2NA | |
| D. | 1molSiO2中含Si-O键的个数为2NA |
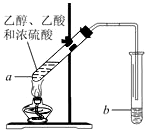 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;