题目内容
I.用中和滴定法测定某烧碱样品的纯度.(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液.
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:
(2)有关数据记录如下:
纯度计算:烧碱样品的纯度为 .
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 .
Ⅱ.现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③ ④(填“>”、“<”或“=”).溶液中的离子浓度由大到小的顺序为 .
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为 ,最终产生H2总量的关系为
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为① ③(填“>”、“<”或“=”)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液.
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:
(2)有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果
Ⅱ.现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①
考点:探究物质的组成或测量物质的含量,中和滴定
专题:实验探究和数据处理题
分析:Ⅰ、(1)滴定过程中,眼睛注视着锥形瓶内溶液颜色的变化;根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(2)先算出两次消耗盐酸的平均体积,然后求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(3)①用蒸馏水冲洗锥形瓶对测定结果无影响;
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,标准液的浓度减少,体积偏大,测定结果偏大;
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果,盐酸体积偏小,测定结果偏小.
Ⅱ、(1)若二溶液体积相同,生成了醋酸钠溶液,显示碱性,所以醋酸应该体积大些;反应后的PH等于7,是醋酸和醋酸钠中性溶液;
(2)c(H+)浓度决定反应速度;硫酸中电离的氢离子最多,醋酸和盐酸的相等;
(5)反应后的溶液相当于向醋酸中分别加入氯化钠和醋酸钠;
(6)氨水加热后氨气挥发,氢氧化钠几乎没有变化.
(2)先算出两次消耗盐酸的平均体积,然后求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(3)①用蒸馏水冲洗锥形瓶对测定结果无影响;
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,标准液的浓度减少,体积偏大,测定结果偏大;
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果,盐酸体积偏小,测定结果偏小.
Ⅱ、(1)若二溶液体积相同,生成了醋酸钠溶液,显示碱性,所以醋酸应该体积大些;反应后的PH等于7,是醋酸和醋酸钠中性溶液;
(2)c(H+)浓度决定反应速度;硫酸中电离的氢离子最多,醋酸和盐酸的相等;
(5)反应后的溶液相当于向醋酸中分别加入氯化钠和醋酸钠;
(6)氨水加热后氨气挥发,氢氧化钠几乎没有变化.
解答:
解:Ⅰ、(1)滴定过程中,眼睛注视着锥形瓶内溶液颜色的变化;滴定终点判断,锥形瓶内溶由红色变无色,半分钟内无颜色变化,
故答案为:溶液由红色变无色,半分钟内无颜色变化;
(2)两次消耗盐酸体积分别为:20.55ml-0.50ml=20.05ml、25.95ml-6.00=19.95;消耗盐酸的平均体积为20.00mL,n(烧碱)=n(盐酸)=0.20mol/L×0.02L=0.004mol,m(烧碱)═nM═0.004mol×40g/mol=0.16g,烧碱的纯度ω(烧碱)=
×100%=80%,故答案为:80%;
(3)①用蒸馏水冲洗锥形瓶对测定结果无影响;
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,标准液的浓度减少,体积偏大,测定结果偏大;
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果,盐酸体积偏小,测定结果偏小;
故答案为:无影响;偏高;偏低.
Ⅱ、(1)将③、④混合,先假设等体积混合,生成醋酸钠,溶液显示碱性,所以醋酸应该体积大些,反应后得到醋酸钠和醋酸的混合溶液,溶液显示中性,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
故答案是:>;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,c(H+)浓度决定反应速度,①②③中氢离子浓度关系为:c(硫酸)>c(盐酸)>c(醋酸),与足量的锌反应,产生H2的量决定于溶液中的n(H+),①②③中氢离子的物质的量关系为;②>①=③,
故答案是:②①③;②>①=③;
(3)向相同体积的①盐酸、③醋酸溶液中分别加入相同浓度、相同体积的CH3COONa溶液,混合后,①是反应生成氯化钠和醋酸,③中醋酸根离子抑制了醋酸电离,氢离子浓度减小,溶液PH增大,所以溶液PH①<③;
故答案是:<;
故答案为:溶液由红色变无色,半分钟内无颜色变化;
(2)两次消耗盐酸体积分别为:20.55ml-0.50ml=20.05ml、25.95ml-6.00=19.95;消耗盐酸的平均体积为20.00mL,n(烧碱)=n(盐酸)=0.20mol/L×0.02L=0.004mol,m(烧碱)═nM═0.004mol×40g/mol=0.16g,烧碱的纯度ω(烧碱)=
| 0.16g×10 |
| 2.0g |
(3)①用蒸馏水冲洗锥形瓶对测定结果无影响;
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,标准液的浓度减少,体积偏大,测定结果偏大;
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果,盐酸体积偏小,测定结果偏小;
故答案为:无影响;偏高;偏低.
Ⅱ、(1)将③、④混合,先假设等体积混合,生成醋酸钠,溶液显示碱性,所以醋酸应该体积大些,反应后得到醋酸钠和醋酸的混合溶液,溶液显示中性,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
故答案是:>;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,c(H+)浓度决定反应速度,①②③中氢离子浓度关系为:c(硫酸)>c(盐酸)>c(醋酸),与足量的锌反应,产生H2的量决定于溶液中的n(H+),①②③中氢离子的物质的量关系为;②>①=③,
故答案是:②①③;②>①=③;
(3)向相同体积的①盐酸、③醋酸溶液中分别加入相同浓度、相同体积的CH3COONa溶液,混合后,①是反应生成氯化钠和醋酸,③中醋酸根离子抑制了醋酸电离,氢离子浓度减小,溶液PH增大,所以溶液PH①<③;
故答案是:<;
点评:本题考查了滴定操作,盐类水解分析,电解质溶液酸碱性的分析判断,电解质溶液中电荷守恒的应用,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响,题目难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、6.0g金刚石中含有的共价键数为NA |
| B、56g铁粉与酸反应失去的电子数一定为0.2 NA |
| C、1 mol?L-1AlCl3溶液中含有3NA个Cl |
| D、标况下,11.2LSO3所含的分子数为0.5NA |
向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到剩余固体物质的组成是( )
| A、NaCl、NaBr、Na2SO4 |
| B、NaCl、Na2SO4 |
| C、NaCl、Na2SO4、I2 |
| D、NaCl、NaI、Na2SO4 |
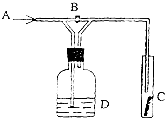 如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )
如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )| A、浓硫酸 |
| B、饱和食盐水 |
| C、浓氢氧化钠溶液 |
| D、氢氧化钙悬浊液 |
X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器中,发生反应X+2Y?2Z.达到平衡时,若他们的物质的量满足:n(X)+n(Y)=n(Z)则Y的转化率为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列各图所示的装置中,肯定不符合防倒吸要求的是( )
A、 |
B、 |
C、 |
D、 |