题目内容
9.下列物质的水溶液因水解而呈酸性的是( )| A. | NaHCO3 | B. | NaNO3 | C. | CaCl2 | D. | NH4Cl |
分析 强酸弱碱盐水解后溶液显酸性,结合盐的类型及水解原理来解答.
解答 解:A.碳酸氢钠为强碱弱酸盐,水解显碱性,故A不选;
B.硝酸钠为强酸强碱盐,不水解,显中性,故B不选;
C.氯化钙为强酸强碱盐,不水解,显中性,故C不选;
D.氯化铵为强酸弱碱盐,水解后溶液显酸性,故D选;
故选D.
点评 本题考查盐类水解,为高频考点,把握盐的类别、水解原理为解答的关键,侧重分析与应用能力的考查,注意水解显酸性的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.苯丙炔酸(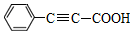 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
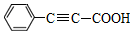 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是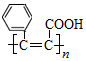 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
20.下列反应的离子方程式正确的是( )
| A. | 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+═2Fe2+ | |
| B. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-═BaSO4↓+H2O |
17.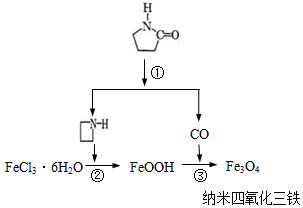 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,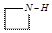 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
4.有一包实验室回收的固体粉末,可能含有Na2CO3、NaCl、CuSO4、FeCl3、FeCl2、MgCl2、Na2SO4中的一种或几种,现进行如下实验:
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
①取少量固体溶于水中,得到澄清透明溶液.
②取少量上述溶液三份,在其中一份溶液中滴加BaCl2溶液,出现白色沉淀,再加入稀盐酸,沉淀不溶解.
③第二份溶液中滴加硝酸酸化的AgNO3,有白色沉淀.
④第三份溶液中滴加KSCN不显红色,再滴加双氧水,溶液显血红色
下列说法正确的是( )
| A. | 固体中一定不含有CuSO4、FeCl3 | |
| B. | 固体中一定不含有Na2CO3、一定含有Na2SO4 | |
| C. | 固体中一定含有FeCl2,不一定含有NaCl | |
| D. | 要检验固体中有没有MgCl2,需再取一份溶液,滴加NaOH溶液,若产生白色沉淀,则含有MgCl2 |
14.短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
| W | X | ||
| Y | Z |
| A. | Z元素的最高价氧化物水化物的酸性强于Y | |
| B. | 由W元素形成的分子W2中存在三个共价键 | |
| C. | 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定 | |
| D. | 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒 |
1.下列各个反应,不能用于工业生产的是( )
| A. | 二氧化锰和浓盐酸共热制氯气 | B. | 煅烧黄铁矿(FeS2)制SO2 | ||
| C. | 氯气与石灰乳反应制漂白粉 | D. | 电解熔融氯化镁制金属镁 |
6.下列性质可以证明某化合物内一定存在离子键的是( )
| A. | 可溶于水 | B. | 熔融状态能导电 | C. | 水溶液能导电 | D. | 具有较高熔点 |