题目内容
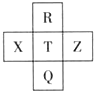
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
| R | ||
| X | T | Z |
| Q |
| A、非金属性:Z<T<X |
| B、R与Q的电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:T<Q |
考点:元素周期律和元素周期表的综合应用
专题:离子反应专题
分析:R单质在暗处与H2剧烈化合并发生爆炸,则R是F元素,根据元素R、X、T、Z、Q在元素周期表中的相对位置知,X是S元素、T是Cl元素、Z是Ar元素、Q是Br元素,
A.同一周期元素,元素的非金属性随着原子序数的增大而增强,但稀有气体较稳定;
B.R与Q的电子数相差26;
C.元素的非金属性越强,其氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外).
A.同一周期元素,元素的非金属性随着原子序数的增大而增强,但稀有气体较稳定;
B.R与Q的电子数相差26;
C.元素的非金属性越强,其氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外).
解答:
解:R单质在暗处与H2剧烈化合并发生爆炸,则R是F元素,根据元素R、X、T、Z、Q在元素周期表中的相对位置知,X是S元素、T是Cl元素、Z是Ar元素、Q是Br元素,
A.同一周期元素,元素的非金属性随着原子序数的增大而增强,但稀有气体较稳定,所以非金属性T>X,故A错误;
B.R的原子序数是9、Q的原子序数是35,则R与Q的电子数的差=35-9=26,故B正确;
C.元素的非金属性越强,其氢化物越稳定,非金属性R>T>Q,所以氢化物的稳定性R>T>Q,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),非金属性T>Q,则元素最高价氧化物的水化物酸性T>Q,故D错误;
故选B.
A.同一周期元素,元素的非金属性随着原子序数的增大而增强,但稀有气体较稳定,所以非金属性T>X,故A错误;
B.R的原子序数是9、Q的原子序数是35,则R与Q的电子数的差=35-9=26,故B正确;
C.元素的非金属性越强,其氢化物越稳定,非金属性R>T>Q,所以氢化物的稳定性R>T>Q,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),非金属性T>Q,则元素最高价氧化物的水化物酸性T>Q,故D错误;
故选B.
点评:本题考查了元素周期表和元素周期律的综合应用,正确推断元素是解本题关键,再结合元非金属性与氢化物的稳定性、最高价含氧酸的酸性之间的关系解答,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、由1L 1 mol?L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
下列叙述正确的是( )
| A、1 mol CO2 的质量为44g/mol |
| B、NA个CO2的质量与CO2的相对分子质量在数值上相同 |
| C、CO2的摩尔质量为44g/mol |
| D、CO2的摩尔质量等于CO2的相对分子质量 |
已知将液溴滴入热的NaOH浓溶液中,发生如下氧化还原反应:3Br2+6NaOH=5NaBr+NaBrO3+3H2O,氧化剂和还原剂的物质的量之比正确的是( )
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
下列实验中主要不是从安全因素考虑的是( )
| A、酒精灯在不使用时,必须盖上灯帽 | ||
| B、不能直接用嘴吹灭酒精灯 | ||
C、酒精少于
| ||
| D、不能用酒精灯点燃另一酒精灯 |
 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
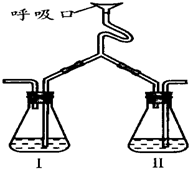 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )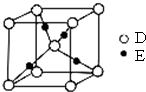 已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满.回答下列问题(用元素符号或化学式表示).