��Ŀ����
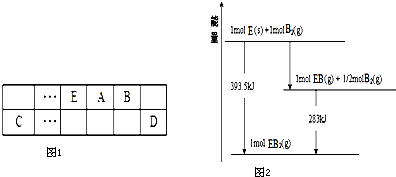
A��B��C��D��E����ѧ��ѧ�г��������ֶ�����Ԫ�أ�������Ԫ�����ڱ��е����λ����ͼ1��
A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C���С���������������������ش��������⣮
��1��A��C��ɵ�һ�����ӻ��������ˮ��Ӧ�������ּ�÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ ���û�������A���Ľṹʾ��ͼΪ ��
��2��A��D���⻯�����Ӧ��������ɫ����G��
�ټ����ù������õ����Լ�����ֽ������ˮ���⣩�� ��
�ڳ����£�a mol/L��G��Һ����pHΪ4����G����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ ��
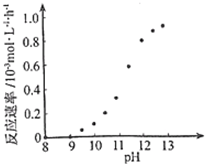
��3����֪һ������E��������B2��g����ȼ�գ�����ܵIJ��P������ϵ��ͼ2��ʾ����д��һ��������EB2��g����E��s����Ӧ����EB��g�����Ȼ�ѧ����ʽΪ ��
��4��C�������������ɵ�ԭ��ؿ������������˼�ʻ��DZ�������õ���Ժ�ˮΪ�������Һ����ع���ʱ�������ĵ缫��ӦʽΪ ��
��5��E��ij�⻯�����Է���������28������������ˮ������Ӧ�Ļ�ѧ����ʽΪ ��

A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ����C���С���������������������ش��������⣮
��1��A��C��ɵ�һ�����ӻ��������ˮ��Ӧ�������ּ�÷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ
��2��A��D���⻯�����Ӧ��������ɫ����G��
�ټ����ù������õ����Լ�����ֽ������ˮ���⣩��
�ڳ����£�a mol/L��G��Һ����pHΪ4����G����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ
��3����֪һ������E��������B2��g����ȼ�գ�����ܵIJ��P������ϵ��ͼ2��ʾ����д��һ��������EB2��g����E��s����Ӧ����EB��g�����Ȼ�ѧ����ʽΪ
��4��C�������������ɵ�ԭ��ؿ������������˼�ʻ��DZ�������õ���Ժ�ˮΪ�������Һ����ع���ʱ�������ĵ缫��ӦʽΪ
��5��E��ij�⻯�����Է���������28������������ˮ������Ӧ�Ļ�ѧ����ʽΪ
���㣺Ԫ�������ɺ�Ԫ�����ڱ����ۺ�Ӧ��,�Ȼ�ѧ����ʽ
ר�⣺��ѧ��Ӧ�е������仯,Ԫ����������Ԫ�����ڱ�ר��
������A��B��C��D��E����ѧ��ѧ�г��������ֶ�����Ԫ�أ�����Ԫ�������ڱ��е�λ��֪��E��A��Bλ�ڵڶ����ڣ�C��Dλ�ڵ������ڣ�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ������A��NԪ�أ�����E��CԪ�ء�B��OԪ�ء�D��ClԪ�أ�C���С���������������������C��MgԪ�أ�
��1��A��C��ɵ�һ�����ӻ�����ΪMg3N2������ˮ��Ӧ�������ּһ���ǰ�����һ����Mg��OH��2���ݴ���д����ʽ���û�������A���к�����7�����ӣ�������10�����ӣ��ݴ���д�����ӵĽṹʾ��ͼ��
��2��A��D���⻯��ֱ���NH3��HCl���������Ӧ������ɫ����G��GΪNH4Cl��
�ٹ���G��NH4Cl�������������������ữ����������Һ������笠�����������������Һ�ͺ�ʪ��ĺ�ɫʯ����ֽ��
�ڳ����£�a mol/L��G��Һ����pHΪ4��笠�����ˮ�����Һ�����ԣ���G����ˮ�ⷴӦ��ƽ�ⳣ��Kh=
��
��3����ͼ��֪��1molC��s����0.5molO2��g����Ӧ�õ�1molCO��g���ų�����=393.5kJ-283kJ=110.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+
O2��g��=CO��g����H=-110.5kJ/mol ��
1molC��s����1molO2��g����Ӧ�õ�1molCO2��g���ų�����393.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol �ڣ�
���ݸ�˹���ɼ��㣻
��4��Mg�������������ɵ�ԭ��أ��õ���Ժ�ˮΪ�������Һ����ع���ʱ��������Mgʧ���ӷ���������Ӧ������˫��ˮ���ӵõ����������������ӣ�
��5��E��ij�⻯�����Է���������28�����������C2H4����ϩ���巢���ӳɷ�Ӧ����1��2-�������飮
��1��A��C��ɵ�һ�����ӻ�����ΪMg3N2������ˮ��Ӧ�������ּһ���ǰ�����һ����Mg��OH��2���ݴ���д����ʽ���û�������A���к�����7�����ӣ�������10�����ӣ��ݴ���д�����ӵĽṹʾ��ͼ��
��2��A��D���⻯��ֱ���NH3��HCl���������Ӧ������ɫ����G��GΪNH4Cl��
�ٹ���G��NH4Cl�������������������ữ����������Һ������笠�����������������Һ�ͺ�ʪ��ĺ�ɫʯ����ֽ��
�ڳ����£�a mol/L��G��Һ����pHΪ4��笠�����ˮ�����Һ�����ԣ���G����ˮ�ⷴӦ��ƽ�ⳣ��Kh=
| c(NH4+)��c(H+) |
| c(NH3��H2O) |
��3����ͼ��֪��1molC��s����0.5molO2��g����Ӧ�õ�1molCO��g���ų�����=393.5kJ-283kJ=110.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+
| 1 |
| 2 |
1molC��s����1molO2��g����Ӧ�õ�1molCO2��g���ų�����393.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol �ڣ�
���ݸ�˹���ɼ��㣻
��4��Mg�������������ɵ�ԭ��أ��õ���Ժ�ˮΪ�������Һ����ع���ʱ��������Mgʧ���ӷ���������Ӧ������˫��ˮ���ӵõ����������������ӣ�
��5��E��ij�⻯�����Է���������28�����������C2H4����ϩ���巢���ӳɷ�Ӧ����1��2-�������飮
���
�⣺A��B��C��D��E����ѧ��ѧ�г��������ֶ�����Ԫ�أ�����Ԫ�������ڱ��е�λ��֪��E��A��Bλ�ڵڶ����ڣ�C��Dλ�ڵ������ڣ�A������������Ӧ��ˮ���������⻯�ﷴӦ�������ӻ������A��NԪ�أ�����E��CԪ�ء�B��OԪ�ء�D��ClԪ�أ�C���С���������������������C��MgԪ�أ�
��1��A��C��ɵ�һ�����ӻ�����ΪMg3N2������ˮ��Ӧ�������ּһ���ǰ�����һ����Mg��OH��2���䷴Ӧ����ʽΪ��Mg3N2+8H2O=3Mg��OH��2��+2NH3?H2O���û�������A���к�����7�����ӣ�������10�����ӣ������ӵĽṹʾ��ͼΪ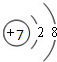 ��
��
�ʴ�Ϊ��Mg3N2+8H2O=3Mg��OH��2��+2NH3?H2O��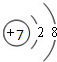 ��
��
��2��A��D���⻯��ֱ���NH3��HCl���������Ӧ������ɫ����G��GΪNH4Cl��
�ٹ���G��NH4Cl�������������������ữ����������Һ������Һ�еμ������ữ����������Һ��������ɰ�ɫ��������˵�����������ӣ�����笠�����������������Һ�ͺ�ʪ��ĺ�ɫʯ����ֽ���������Һ�еμ�����������Һ�����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬˵����Һ�к���笠����ӣ�
�ʴ�Ϊ������������Һ����ɫʯ����ֽ��pH��ֽ���� ��������Һ��ϡ���
�ڳ����£�a mol/L��G��Һ����pHΪ4��笠�����ˮ�����Һ�����ԣ���G����ˮ�ⷴӦ��ƽ�ⳣ��Kh=
=
=
��
�ʴ�Ϊ��
��
��3����ͼ��֪��1molC��s����0.5molO2��g����Ӧ�õ�1molCO��g���ų�����=393.5kJ-283kJ=110.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+
O2��g��=CO��g����H=-110.5kJ/mol ��
1molC��s����1molO2��g����Ӧ�õ�1molCO2��g���ų�����393.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol �ڣ�
���ݸ�˹���ɣ��١�2-�ڵã�CO2��g��+C��s��=2CO��g����H=+172.5kJ/mol��
�ʴ�Ϊ��CO2��g��+C��s��=2CO��g����H=+172.5kJ/mol��
��4��Mg�������������ɵ�ԭ��أ��õ���Ժ�ˮΪ�������Һ����ع���ʱ��������Mgʧ���ӷ���������Ӧ������˫��ˮ���ӵõ����������������ӣ��缫��ӦʽΪH2O2+2e-=2OH-���ʴ�Ϊ��H2O2+2e-=2OH-��
��5��E��ij�⻯�����Է���������28�����������C2H4����ϩ���巢���ӳɷ�Ӧ����1��2-�������飬��Ӧ����ʽΪCH2=CH2+Br2��CH2BrCH2Br���ʴ�Ϊ��CH2=CH2+Br2��CH2BrCH2Br��
��1��A��C��ɵ�һ�����ӻ�����ΪMg3N2������ˮ��Ӧ�������ּһ���ǰ�����һ����Mg��OH��2���䷴Ӧ����ʽΪ��Mg3N2+8H2O=3Mg��OH��2��+2NH3?H2O���û�������A���к�����7�����ӣ�������10�����ӣ������ӵĽṹʾ��ͼΪ
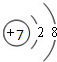 ��
���ʴ�Ϊ��Mg3N2+8H2O=3Mg��OH��2��+2NH3?H2O��
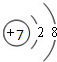 ��
����2��A��D���⻯��ֱ���NH3��HCl���������Ӧ������ɫ����G��GΪNH4Cl��
�ٹ���G��NH4Cl�������������������ữ����������Һ������Һ�еμ������ữ����������Һ��������ɰ�ɫ��������˵�����������ӣ�����笠�����������������Һ�ͺ�ʪ��ĺ�ɫʯ����ֽ���������Һ�еμ�����������Һ�����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ����ɫ�����壬˵����Һ�к���笠����ӣ�
�ʴ�Ϊ������������Һ����ɫʯ����ֽ��pH��ֽ���� ��������Һ��ϡ���
�ڳ����£�a mol/L��G��Һ����pHΪ4��笠�����ˮ�����Һ�����ԣ���G����ˮ�ⷴӦ��ƽ�ⳣ��Kh=
| c(NH4+)��c(H+) |
| c(NH3��H2O) |
| 10-4��(10-4-10-10) |
| a-(10-4-10-10) |
| 10-8 |
| a-10-4 |
�ʴ�Ϊ��
| 10-8 |
| a-10-4 |
��3����ͼ��֪��1molC��s����0.5molO2��g����Ӧ�õ�1molCO��g���ų�����=393.5kJ-283kJ=110.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+
| 1 |
| 2 |
1molC��s����1molO2��g����Ӧ�õ�1molCO2��g���ų�����393.5kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol �ڣ�
���ݸ�˹���ɣ��١�2-�ڵã�CO2��g��+C��s��=2CO��g����H=+172.5kJ/mol��
�ʴ�Ϊ��CO2��g��+C��s��=2CO��g����H=+172.5kJ/mol��
��4��Mg�������������ɵ�ԭ��أ��õ���Ժ�ˮΪ�������Һ����ع���ʱ��������Mgʧ���ӷ���������Ӧ������˫��ˮ���ӵõ����������������ӣ��缫��ӦʽΪH2O2+2e-=2OH-���ʴ�Ϊ��H2O2+2e-=2OH-��
��5��E��ij�⻯�����Է���������28�����������C2H4����ϩ���巢���ӳɷ�Ӧ����1��2-�������飬��Ӧ����ʽΪCH2=CH2+Br2��CH2BrCH2Br���ʴ�Ϊ��CH2=CH2+Br2��CH2BrCH2Br��
���������⿼����Ԫ�����ڱ���Ԫ�������ɵ��ۺ�Ӧ�ã��漰��˹���ɡ��ӳɷ�Ӧ�����Ӽ��顢����ˮ���֪ʶ�㣬����Ԫ�����ڱ���ԭ�ӽṹȷ��Ԫ�أ��ٽ��˹���ɡ����ӵļ��鷽��������ˮ�ⷽ��ʽ��֪ʶ�����������֪����������ӡ������ӡ�笠����ӡ��������Ӽ������ӵļ��鷽����Ϊ������㣬�ѵ�������ˮ��ƽ�ⳣ���ļ��㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
�����Ŀ
��֪��Һ������ȵ�NaOHŨ��Һ�У���������������ԭ��Ӧ��3Br2+6NaOH=5NaBr+NaBrO3+3H2O���������ͻ�ԭ�������ʵ���֮����ȷ���ǣ�������
| A��.1��2 | B��.1��5 |
| C��.5��1 | D��2��1 |
����amol Na2SO3����Һ�뺬bmol Na2S����Һ��Ϻ���������������ϡ���ᣬ����������dz��ɫ������������ʹƷ����ɫ�������������a��b�ı�ֵΪ��������
| A������2 | ||
| B����2 | ||
| C������2 | ||
D������
|
 ��1�����ʱ���Ƽ����Դ��
��1�����ʱ���Ƽ����Դ��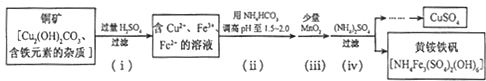
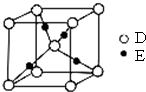 ��֪A��B��C��D���Ƕ�����Ԫ�أ����ǵ�ԭ�Ӱ뾶��СΪB��C��D��A��B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ����2��δ�ɶԵ��ӣ�A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壮E�ǵ�������Ԫ�أ���ԭ�Ӻ���������������Aԭ����ͬ�����������Ӿ��������ش��������⣨��Ԫ�ط��Ż�ѧʽ��ʾ����
��֪A��B��C��D���Ƕ�����Ԫ�أ����ǵ�ԭ�Ӱ뾶��СΪB��C��D��A��B�Ļ�̬ԭ���е���ռ������������ͬ��ԭ�ӹ������ÿ�ֹ���еĵ���������ͬ��Dԭ����2��δ�ɶԵ��ӣ�A��B��D����Ԫ����ɵ�һ�ֻ�����M����װ�����г����е�һ���к����壮E�ǵ�������Ԫ�أ���ԭ�Ӻ���������������Aԭ����ͬ�����������Ӿ��������ش��������⣨��Ԫ�ط��Ż�ѧʽ��ʾ����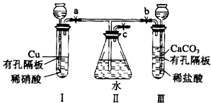 ����ͼʵ��װ�ã�����a��b��cΪ���ɼУ�
����ͼʵ��װ�ã�����a��b��cΪ���ɼУ�