题目内容
17.下列各组物质可用分液漏斗分离的是( )| A. | 甲苯和水 | B. | 乙酸乙酯和乙醇 | C. | 溴水和酒精 | D. | 苯和硝基苯 |
分析 能用分液漏斗分离的物质必须是两种相互不溶的液体,一般的来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂.
解答 解:题中乙酸乙酯和乙醇、溴水和酒精、苯和硝基苯混溶,不能用分液的方法分离,而甲苯不溶于水,溶液分层,可用分液的方法分离.
故选A.
点评 本题考查物质的分离、提纯,为高频考点,题目难度不大,注意物质的性质的异同以及常见物质的分离方法,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
7. 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:
(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
①由此计算得出△H=12x+5n-4y-12m (用上表中字母表示)kJ•mol-1.
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
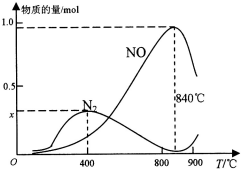
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
8.下列实验能成功的是( )
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
5.下列对气体或溶液中的离子鉴定方案正确的是( )
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
12.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.5 g甲基(-CH3)所含电子数目为NA | |
| B. | 0.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11 g,其中所含的中子数为5NA | |
| D. | 1 mol Fe溶于过量硝酸,电子转移数为2NA |
2.下列有关胶体的说法错误的是( )
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 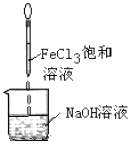 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
9.关于1mol•L-1的硫酸溶液的下列叙述中,不正确的是( )
| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性 |