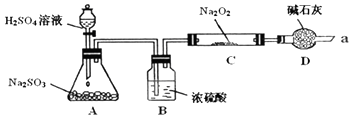
题目内容
9.关于1mol•L-1的硫酸溶液的下列叙述中,不正确的是( )| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性 |
分析 A.1mol/L的硫酸1L时其物质的量=1mol/L×1L=1mol,硫酸的质量=nM;
B.溶液浓度具有均一性,溶液浓度大小与溶液体积无关;
C.49g硫酸物质的量=$\frac{4.9g}{98g/mol}$=0.05mol,将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,溶液体积大于50mL;
D.硫酸属于酸,具有酸的通性.
解答 解:A.1mol/L的硫酸1L时其物质的量=1mol/L×1L=1mol,硫酸的质量=nM=1mol×98g/mol=98g,故A正确;
B.溶液浓度具有均一性,溶液浓度大小与溶液体积无关,所以从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变,故B正确;
C.49g硫酸物质的量=$\frac{4.9g}{98g/mol}$=0.05mol,将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,溶液体积大于50mL,则配制溶液浓度小于1mol/L,故C错误;
D.硫酸属于酸,具有酸的通性,石蕊试液遇该硫酸变红色,该硫酸能和较活泼金属反应生成氢气,能和碱反应生成盐和水,故D正确;
故选C.
点评 本题考查物质的量浓度计算、酸的性质等知识点,侧重考查学生判断及计算能力,明确物质的量公式中各个物理量关系、溶液特点是解本题关键,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
19.已知反应mX(g)+nY(g)?qZ(g)△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | X的正反应速率是Y 的逆反应速率的$\frac{m}{n}$倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 增加X的物质的量,平衡常数增大 |
20.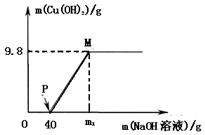 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
17.下列各组物质可用分液漏斗分离的是( )
| A. | 甲苯和水 | B. | 乙酸乙酯和乙醇 | C. | 溴水和酒精 | D. | 苯和硝基苯 |
14.某同学在实验报告中有以下实验数据记录,其中合理的是( )
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
1.下列电离方程式正确的是( )
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
18.下列变化中,需加入氧化剂才能实现的是( )
| A. | N2→NH3 | B. | MgCl2→MgSO4 | C. | Cu→CuO | D. | FeO→Fe |
18. 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
(1)一定温度下,反应2NO2(g)?N2O4 (g)△S<0,该反应能自发进行的原因是△H<0(选填“=”、“>”、“<”)
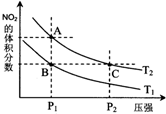
(2)对反应2NO2(g)?N2O4(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.0025mol•(L•s)-1.
②2NO2(g)?N2O4(g)该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正>v逆(填“>”、“<”或“=”),升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.(1)一定温度下,反应2NO2(g)?N2O4 (g)△S<0,该反应能自发进行的原因是△H<0(选填“=”、“>”、“<”)
(2)对反应2NO2(g)?N2O4(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②2NO2(g)?N2O4(g)该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正>v逆(填“>”、“<”或“=”),升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.