题目内容
12.设NA 为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1.5 g甲基(-CH3)所含电子数目为NA | |
| B. | 0.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11 g,其中所含的中子数为5NA | |
| D. | 1 mol Fe溶于过量硝酸,电子转移数为2NA |
分析 A.1个甲基含有9个电子;
B.Mg反应后变为+2价;
C.由2H和18O所组成水的摩尔质量为22g/mol;
D.铁与过量硝酸反应生成三价铁离子.
解答 解:A.1.5 g甲基(-CH3)物质的量为$\frac{1.5g}{15g/mol}$=0.1mol,所含电子数目为0.9NA,故A错误;
B.Mg反应后变为+2价,故0.1mol镁无论产物是什么,则均失去0.2NA个电子,故B正确;
C.由2H和18O所组成水的摩尔质量为22g/mol,故22g水的物质的量为1mol,而由2H和18O所组成水中含12个中子,故1mol此水则含12NA个中子,故C错误;
D.1 mol Fe溶于过量硝酸生成1mol三价铁离子,电子转移数为3NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.为汽车尾气的治理,环境工作者面临着巨大的挑战.试回答以下问题:
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数K=-9.7×10-4,NO2-的水解常数K=-8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kb的代数式表示),此时溶液的温度>25℃(填“>”“<”或“=”).
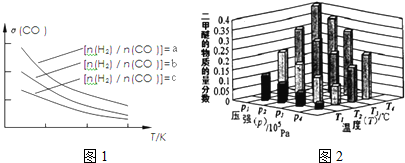
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g).
该反应的正反应放热为反应(填“放热”或“吸热”).若起始时向容器I中充入CH3OH 0.15mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正方向进行(填“正”或“逆”).
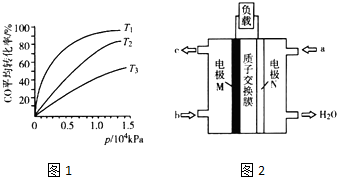
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向N电极区(填“M”或“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.

(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数K=-9.7×10-4,NO2-的水解常数K=-8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kb的代数式表示),此时溶液的温度>25℃(填“>”“<”或“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向N电极区(填“M”或“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
3.理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,符合绿色化学的概念.下列反应类型中完全符合要求的是( )
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
20.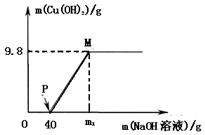 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
17.下列各组物质可用分液漏斗分离的是( )
| A. | 甲苯和水 | B. | 乙酸乙酯和乙醇 | C. | 溴水和酒精 | D. | 苯和硝基苯 |
1.下列电离方程式正确的是( )
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
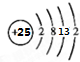 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.