题目内容
15.掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
(1)写出下列仪器的名称:①蒸馏烧瓶,②锥形瓶.
(2)仪器①~④中,使用时必须检查是否漏水的有④.(填序号)
(3)若利用装置I分离丙三醇(能跟水、酒精以任意比互溶,沸点290℃)和酒精(沸点78.2℃)的混合物,还缺少的仪器有酒精灯,将仪器补充完整后进行的实验操作的名称为;蒸馏.进水方向是g (填g或f),还需加入少量碎瓷片,其作用是防止暴沸.
(4)如图所示装置Ⅱ是转移操作,请指出该操作错误之处:用玻璃棒引流.
分析 实验室制取蒸馏水用到的是蒸馏实验,蒸馏用到的仪器为:酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶,注意温度计测量的是蒸汽温度,水银球应放在蒸馏烧瓶支管口出,蒸馏时,冷却水从冷凝管的下口通入,上口流出,可使冷凝管充满冷水而进行充分冷却,据此解答,
(1)根据仪器的结构特点判断;
(2)有活塞和玻璃塞的仪器使用时必须检查是否漏水;
(3)分离丙三醇(能跟水、酒精以任意比互溶,沸点290℃)和酒精(沸点78.2℃)的混合物需要通过蒸馏,蒸馏烧瓶需要加热,冷凝需要逆流,烧瓶中加入碎瓷片防止液体暴沸;
(4)配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误,烧杯溶液转移到容量瓶中需要沿玻璃棒转移.
解答 解:(1)依据仪器构造可知:①是蒸馏烧瓶,②是锥形瓶;
故答案为:蒸馏烧瓶;锥形瓶;
(2)容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管、锥形瓶不需要检查是否漏水,
故答案为:④;
(3)制取蒸馏水的过程实质是蒸馏过程,必须用酒精灯加热,将仪器补充完整后进行的实验操作的名称为蒸馏,冷凝管下口是进水口,上口是出水口,所以冷凝管中冷却水从g口进,加入少量碎瓷片,其作用是防止混合液体加热暴沸,
故答案为:酒精灯; 蒸馏;g; 防止暴沸;
(4)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,
故答案为:用玻璃棒引流.
点评 本题考查学生化学实验的基本操作知识,为高频考点,侧重于学生的基本实验技能的考查,熟悉蒸馏实验的原理和用到的仪器以及溶液的配制方法是解题关键,注意温度计位置、冷凝水流向等,题目难度不大.

练习册系列答案
相关题目
5.最新研究表明:用CH4催化还原NO2可以消除氮氧化合物引起的污染,例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法正确的是( )
| A. | 等物质的量的CH4在反应①、②中转移的电子数不相同 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol | |
| C. | 4NO2(g)+2N2(g)═8NO(g);△H=+586kJ/mol | |
| D. | 若用2.24LCH4把NO2还原为N2,整个过程中转移的电子总数为0.8NA |
6.下列分子中,中心原子杂化轨道类型相同,分子的空间构型也相同的是( )
| A. | BeCl2、CO2 | B. | H2O、SO2 | C. | SO2、CH4 | D. | NF3、CH2O |
10.相同质量的下列有机物在氧气中充分燃烧,生成CO2最多的是( )
| A. | C4H10 | B. | C6H6 | C. | C6H14 | D. | C8H10 |
7.球墨铸铁中含有一种铁碳化合物X.实验室测定化合物X的组成实验如下:
化合物18.0g$→_{高温煅烧}^{足量空气}$固体1$\stackrel{过量盐酸}{→}$溶液甲$\stackrel{足量Cl_{2}}{→}$溶液乙$→_{灼烧}^{加热、蒸发}$固体24.0g
下列说法不正确的是( )
化合物18.0g$→_{高温煅烧}^{足量空气}$固体1$\stackrel{过量盐酸}{→}$溶液甲$\stackrel{足量Cl_{2}}{→}$溶液乙$→_{灼烧}^{加热、蒸发}$固体24.0g
下列说法不正确的是( )
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲中可能含有Fe3+ | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
4.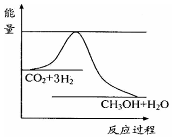 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol) -1该反应能否自发进行与温度 有关.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数
①实验2中以υ(CO2) 表示的平均反应速率为0.16mol•(L•min)-1.900℃是该反应的平衡常数0.17.
②该反应为吸热(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2.
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol) -1该反应能否自发进行与温度 有关.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②该反应为吸热(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2.
5.下列有关物质的性质或该物质性质的应用均正确的是( )
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |