题目内容
6.将19.5g锌粉加入到2L的0.100mol•L-1 MO2+ 溶液中,恰好完全反应,则还原产物可能是( )| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
分析 根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算反应后M元素的化合价,进而可判断还原产物.
解答 解:n(Zn)=$\frac{19.5g}{65g/mol}$=0.3mol,n(MO2+)=2L×0.100mol•L-1=0.2mol,设反应后M的化合价为+x价,
则(5-x)×0.2mol=0.3mol×(2-0),
x=2,
故选B.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等.

练习册系列答案
相关题目
16.将下列物质按酸、碱、盐分类排列,正确的是( )
| A. | 硫酸 纯碱 硫酸钙 | |
| B. | 氢氯酸 烧碱 硫酸亚铁 | |
| C. | 碳酸 乙醇 烧碱 | |
| D. | 磷酸 熟石灰 苛性钠 |
17.800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由图分析不能得出的结论是( )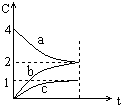

| A. | a是反应物 | B. | 正反应是一个体积扩大的反应 | ||
| C. | 若升高温度,a的转化率增大 | D. | 若增大压强,a的转化率减小 |
14.下列用电子式表示物质的结构中正确的是( )
| A. | K2S | B. | H2S | ||
| C. | (NH4)2S | D. | BaF2 |
1.下列反应过程中,最终溶液保持原来颜色的是( )
| A. | 向滴有酚酞的NaOH溶液中通入过量的CO2气体 | |
| B. | 向酸性KMnO4溶液中加入足量的H2O2 | |
| C. | 向含有KSCN的FeC13溶液中加入足量的Cu粉 | |
| D. | 向品红溶液中通入足量的等体积混合的Cl2与SO2气体 |
11.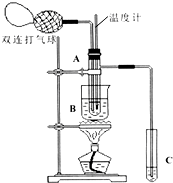 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内,60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇或甘油(在题给物质中确定).
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内,60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇或甘油(在题给物质中确定).
16.反应2NO+O2=2NO2,不能使该反应的反应速率增大的是( )
| A. | 及时分离出NO2气体 | B. | 适当升高温度 | ||
| C. | 增大O2的浓度 | D. | 选择高效催化剂. |



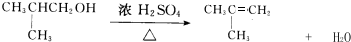 ;H→G
;H→G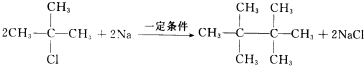 .
.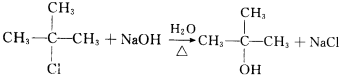 .
.