题目内容
15.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:(1)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O.
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(1)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol,每转移4mol电子,理论上放出热量436.7kJ.
(3)肼一空气燃料电池是一种碱性电池,工作时释放出N2,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+4H2O.
分析 (1)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①,求解;
(3)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2.
解答 解:(1)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;由反应方程式可知每转移8mol电子,放出873.4kJ的热量,所以每转移4mol电子,理论上放出热量436.7kJ,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;436.7;
(3)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2↑+4H2O.
点评 本题考查盖斯定律、电极反应式的书写等知识点,这些都是高考的热点,注意电极反应式的书写要结合电解质溶液的酸碱性,难度中等.

| A. | 萃取 | B. | 过滤 | C. | 分液 | D. | 蒸馏 |
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
| A. | 2vB正=3vA正 | |
| B. | 3vC正=2vB逆 | |
| C. | 容器中气体的平均相对分子质量不再改变 | |
| D. | 反应容器中压强不随时间变化 |
| A. | Fe2+、NO3-、Na+、Cl- | B. | Mg2+、Na+、CH3COO-、Cl- | ||
| C. | SO42-、HCO3-、K+、Na+ | D. | Ba2+、Na+、NO3-、Cl- |
| 装置 | 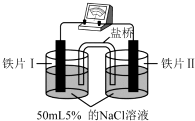 | 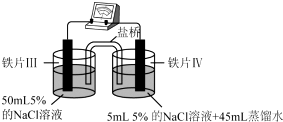 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 | |
| C. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等 | |
| D. | 铁片Ⅳ的电极反应式为Fe-3e-=Fe3+ |
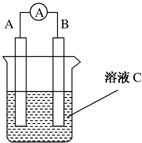 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答: