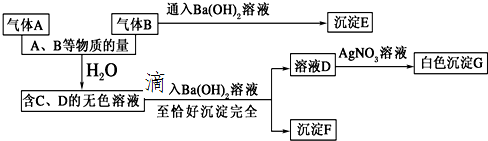
题目内容
17.800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由图分析不能得出的结论是( )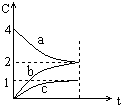
| A. | a是反应物 | B. | 正反应是一个体积扩大的反应 | ||
| C. | 若升高温度,a的转化率增大 | D. | 若增大压强,a的转化率减小 |
分析 根据图象可知,达到平衡时a的浓度减小2个单位,b的浓度增大2个单位,c的浓度增大1个单位,据此可知该反应的方程式为:2a(g)?2b(g)+c(g),据此结合化学平衡的影响因素进行解答.
解答 解:根据图象可知,达到平衡时a的浓度减小2个单位,b的浓度增大2个单位,c的浓度增大1个单位,据此可知该反应的方程式为:2a(g)?2b(g)+c(g),
A.根据分析可知,a为反应物,故A正确;
B.该反应中,反应物总体积为2,生成物总体积为3,则正反应是体积增大的反应,故B正确;
C.根据图象无法判断该反应是吸热反应还是放热反应,则无法判断温度对a的转化率的影响,故C错误;
D.该反应为气体体积增大的反应,增大压强后平衡向着逆向移动,则a的转化率减小,故D正确;
故选C.
点评 本题考查了化学平衡及其影响,题目难度不大,根据图象数据确定该反应方程式为解答关键,注意熟练掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
7.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.
(1)要在食盐中加碘,是因为碘是人体内合成甲状腺激素的主要原料,缺碘会引起疾病.在人体中,碘是属于微量(选填“常量”或“微量”)元素.
(2)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(3)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(4)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时是分解(容易还是不容易)分解.
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
(2)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(3)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(4)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时是分解(容易还是不容易)分解.
8.居里夫人因对Ra(镭)元素的研究两次获得诺贝尔奖.人们在测定物质放射性时通常用${\;}_{88}^{226}$Ra作为标准.下列有关${\;}_{88}^{226}$Ra的说法不正确的是( )
| A. | ${\;}_{88}^{226}$Ra的质量数为226,在数值上等于该原子的近似相对原子质量 | |
| B. | Ra元素位于周期表中第六周期第ⅡA族 | |
| C. | ${\;}_{88}^{226}$Ra元素的金属性比Mg的强 | |
| D. | Ra的最高价氧化物对应的水化物是强碱 |
5.用于分离两种互不溶性液体的实验操作是( )
| A. | 萃取 | B. | 过滤 | C. | 分液 | D. | 蒸馏 |
12.填写下表中的空格:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)${\;}_{19}^{40}$K | 19 | 40 | ||
| (2) | 16 | 18 | 32 |
6.将19.5g锌粉加入到2L的0.100mol•L-1 MO2+ 溶液中,恰好完全反应,则还原产物可能是( )
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
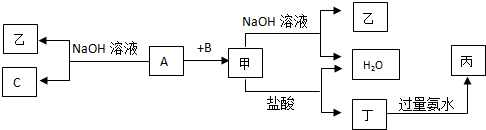
 .
.