题目内容
16. 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
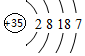
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.(1)氯元素同族的下一周期元素的原子结构示意图为
 ,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.
,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.(3)碘被称为“智力元素”,碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与碘化钾生成单质碘.写出该反应的离子方程式IO3-+5I-+6H+═3H2O+3I2.
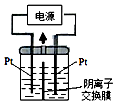
(4)①电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
已知:3I2+6OH-═IO3-+5I-+3H2O
下列说法正确的是ABCD
A.右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B.电解结束时,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式KI+3H2O═KIO3+3H2↑(条件通电)
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式会改变
②电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
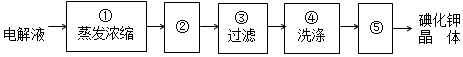
步骤⑤的操作名称干燥
(5)已知:I2+2S2O32-=S4O62-+2I-.溶度积常数Ksp(CuCl)=1.7×10-7 Ksp( CuI)=1.3×10-12
用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取a g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用c mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液b mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是滴最后一滴硫代硫酸钠时,溶液蓝色褪去,半分钟内不恢复.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为$\frac{171bc×1{0}^{-3}}{a}$×100%.
分析 (1)氯元素同族的下一周期元素的原子为溴原子,原子序数为35,核外电子分四层排布,据此画出原子结构示意图;碘单质为紫黑色固体;
(2)Ca5(PO4)3(OH)生成Ca5(PO4)3F,反应后同时生成OH-;
(3)在酸性条件碘酸根离子和碘离子发生氧化反应生成碘单质;
(4)①左侧溶液变蓝色,生成I2,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,右侧放出氢气,右侧I-、OH-通过阴离子交换膜向左侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,如果用阳离子交换膜代替阴离子交换膜,左侧多余K+通过阳离子交换膜迁移至阴极,保证两边溶液呈电中性;
②从热溶液中析出晶体的方法是冷却结晶;洗涤后的晶体要进行干燥;洗涤晶体的目的:洗去吸附在碘酸钾晶体上的氢氧化钾等杂质;
(5)①淀粉遇到碘变蓝,依据I2+2S2O32-═S4O62-+2I-可知,当Na2S2O3标准溶液刚好将碘全部反应,淀粉由蓝色变成无色,据此解答;
②CuCl2溶液与KI反应实质铜离子氧化碘离子生成生成碘化亚铜沉淀和单质碘;
③依据碘单质被Na2S2O3标准溶液滴定到终点,发生反应离子方程式得到 2Na2S2O3~2Cu2+计算.
解答 解:(1)氯元素同族的下一周期元素的原子为溴原子,原子序数为35,原子结构示意图为 ,碘单质为紫黑色固体,
,碘单质为紫黑色固体,
故答案为: ; 紫黑色;
; 紫黑色;
(2)由题意氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石可知,反应离子方程式为Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq),
故答案为:Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq);
(3)在酸性条件碘酸根离子和碘离子发生氧化反应生成碘单质,离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+═3H2O+3I2;
(4)①A.左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故A正确;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确;
C.左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑,故C正确;
D.用阴离子交换膜,电解槽内发生的总化学方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑,如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+I2+H2↑,故D正确;
故答案为:ABCD;
②从热溶液中析出晶体的方法是:冷却结晶;洗涤后的晶体有水分,所以要进行干燥;过滤后得到的晶体上吸附部分氢氧化钾等杂质,为得到较纯净的碘酸钾晶体,所以要进行洗涤,据此可知步骤⑤的操作名称为干燥,
故答案为:干燥;
(5)①淀粉遇到碘变蓝,依据I2+2S2O32-═S4O62-+2I-可知,当Na2S2O3标准溶液刚好将碘全部反应,淀粉由蓝色变成无色,所以可以淀粉做指示剂,当淀粉由蓝色变成无色且半分钟不变化滴定达到终点;
故答案为:淀粉溶液; 滴最后一滴硫代硫酸钠时,溶液蓝色褪去,半分钟内不恢复;
②CuCl2溶液与KI反应实质铜离子氧化碘离子生成生成碘化亚铜沉淀和单质碘,离子方程式:2Cu2++4I-=2CuI↓+I2;
故答案为:2Cu2++4I-=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3~2Cu2+
2 2
试样中CuCl2•2H2O的物质的量为b mL×c mol/L,
试样中CuCl2•2H2O的质量百分数=$\frac{171bc×1{0}^{-3}}{a}$×100%,
故答案为:$\frac{171bc×1{0}^{-3}}{a}$×100%.
点评 本题考查了碘的物理性质、电解原理、碘离子的检验等性质,为高频考点,题目难度中等,涉及物质分离和提纯、基本实验操作计算等知识点,侧重分析与实验能力的考查.

 名校课堂系列答案
名校课堂系列答案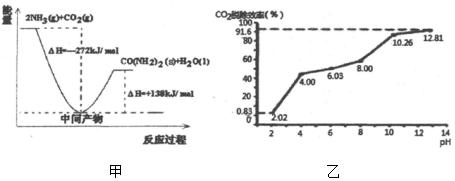
(1)H2NCOONH4是工业合成尿素[CO(NH2)2]的中间产物,该反应的能量变化示意图如图甲所示,用CO2和氨气合成尿素的热化学方程式为CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol.
(2)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成碳酸氢铵的主要化学方程式CO2+NH3.H2O=NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图乙所示,烟气中CO2的含量为12%,烟气通入氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为0.13mol(精确到0.01).
③通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成CO2.
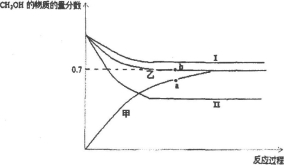
(3)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol.在T1℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应过程如下图所示.
| 容器 | 甲 | 乙 | 丙 |
| 起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
②b点时反应吸收的能量为11.25kJ.
| A. | Na2S | B. | NH4NO3 | C. | H2 | D. | CS2 |
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
| A. | 丁烷有3种同分异构体 | |
| B. | 己烷共有5种同分异构体,它们的熔、沸点各不相同 | |
| C. | “可燃冰”的主要成分是甲烷和水 | |
| D. | 多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是四氯化碳 |
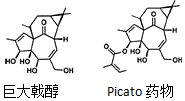 2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )
2016 年化学领域重要成果之一是丹麦制药公司LEO Pharma与美国斯克里普斯研究所(The Scripps Research Institute)的Phil S.Baran课题组合作,成功地将合成巨大戟醇(一个分子中含有20个碳原子)的步骤由37步缩短至14步.巨大戟醇是合成治疗日光性角化病药物(Picato)的原料.下列说法错误的是( )| A. | 由巨大戟醇制备Picato药物的另一种反应物是(CH3)2C=CHCOOH | |
| B. | 巨大戟醇能发生取代反应、氧化反应、加成反应 | |
| C. | 巨大戟醇和Picato药物都不属于芳香族化合物 | |
| D. | 0.1mol巨大戟醇完全燃烧消耗2.45molO2 |
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸与足量金属Na反应生成生成lmolH2 | |
| B. | 1mol苹果酸可与3molNaOH发生中和反应 | |
| C. | 苹果酸中能发生酯化反应的官能团有2种 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| A. | ⅢB族 | B. | ⅢA族 | C. | ⅤⅢ族 | D. | 0族 |