题目内容
18.下列离子方程式书写正确的是( )| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氧化镁与稀盐酸混合:MgO+H+═Mg2++H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
分析 A.Fe和铜离子发生置换反应生成Cu和亚铁离子;
B.MgO和稀盐酸反应生成可溶性氯化镁和水,原子不守恒;
C.难溶物碳酸钙要写化学式;
D.漏写生成水的离子方程式.
解答 解:A.Fe和铜离子发生置换反应生成Cu和亚铁离子,离子方程式为Fe+Cu2+═Fe2++Cu,故A正确;
B.MgO和稀盐酸反应生成可溶性氯化镁和水,原子不守恒,离子方程式为MgO+2H+═Mg2++H2O,故B错误;
C.难溶物碳酸钙要写化学式,离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.漏写生成水的离子方程式,离子方程式为2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查离子方程式书写正误判断,为高频考点,明确离子方程式书写规则及反应实质是解本题关键,注意要遵循客观事实、原子守恒、电荷守恒及转移电子守恒,易错选项是D.

练习册系列答案
相关题目
14.下列关于漂白粉的叙述正确的是( )
| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉是由Cl2与烧碱制得的 | |
| D. | 在使用漂白粉时应用浓盐酸 |
6.食盐中通常添加碘酸钾来补充碘元素,我国规定食盐的含碘量(按每千克食盐含碘元素计)为20~40mg/kg,则每千克食盐中加入碘酸钾的质量应不少于(设碘酸钾的摩尔质量为M g•mol-1)( )
| A. | $\frac{{20M×{{10}^{-3}}}}{127}$g | B. | 20M g | C. | $\frac{{20×{{10}^{-3}}}}{M}$g | D. | $\frac{20}{M}$g |
13.高温下,某反应平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容条件下达到平衡时,温度升高H2浓度减小.下列说法正确的是( )
| A. | 该反应的化学方程式为CO+H2O$?_{高温高压}^{催化剂}$CO2+H2 | |
| B. | 该反应的焓变为正值 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 升高温度,平衡右移,逆反应速率减小 |
10.下列有关钠单质及其化合物的说法错误的是( )
| A. | Na2O2可用作呼吸面具的供氧剂 | |
| B. | 侯德榜“联合制碱法”制取的是碳酸钠 | |
| C. | 钠与乙醇反应,钠块沉入试管底部 | |
| D. | NaHCO3的热稳定性大于Na2CO3 |
7.水体富营养化可导致赤潮、水华等水污染现象.下列与水体富营养化密切相关的元素是( )
| A. | C | B. | O | C. | P | D. | S |
8.随着科技的不断进步,15N、N70、N5+、NH5等已被发现.下列有关说法中,正确的是( )
| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
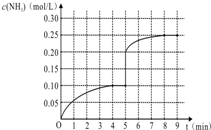 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: