题目内容
14.下列关于漂白粉的叙述正确的是( )| A. | 漂白粉的有效成分是Ca(ClO)2和CaCl2 | |
| B. | 漂白粉在空气中久置后会变质 | |
| C. | 漂白粉是由Cl2与烧碱制得的 | |
| D. | 在使用漂白粉时应用浓盐酸 |
分析 氯气与石灰乳反应可制备漂白粉,主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2,空气中Ca(ClO)2与水、二氧化碳反应生成碳酸钙混合HClO,HClO光照分解而变质,以此来解答.
解答 解:A.漂白粉的有效成分是Ca(ClO)2,故A错误;
B.空气中Ca(ClO)2与水、二氧化碳反应生成碳酸钙混合HClO,HClO光照分解而变质,故B正确;
C.氯气与烧碱反应生成NaCl、NaClO,故C错误;
D.使用漂白粉时与浓盐酸发生氧化还原反应生成氯气,氯气有毒,故D错误;
故选B.
点评 本题考查漂白粉的制备及性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
4.下列表述正确的是( )
| A. | 硫酸铝的电离方程式:Al2(SO4)3=2Al3++3SO42- | |
| B. | 小苏打的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Mg(OH)2难溶于水,所以Mg(OH)2不是电解质,而是非电解质 | |
| D. | K2CO3溶液能导电,所以K2CO3溶液是电解质 |
5.下列离子方程式书写正确的是( )
| A. | 向澄清石灰水中通入足量二氧化碳:2OH?+CO2═CO32?+H2O | |
| B. | 氧化钠投入水中发生反应:O2?+H2O═2OH? | |
| C. | 醋酸溶液滴入到NaOH溶液中:CH3COOH+OH?═CH3COO?+H2O | |
| D. | 铁和稀盐酸反应制氢气:2Fe+6H+═2Fe3++3H2↑ |
9.对于反应8NH3+3Cl2═N2+6NH4Cl,下列说法正确的是( )
| A. | N2是还原产物,且还原剂与氧化剂物质的量之比是2:3 | |
| B. | N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 | |
| C. | 每转移6mol电子就生成22.4LN2 | |
| D. | NH4Cl是氧化产物,且还原产物与氧化产物物质的量之比是1:6 |
19.某山区较多人的牙齿骨质舒松,可能因为该地区水中( )
| A. | 含碘量较高 | B. | 含硫量较高 | C. | 含汞量较高 | D. | 含氟量较高 |
6.除去乙烷中乙烯的办法是( )
| A. | 与氢气加成 | B. | 通过溴水 | ||
| C. | 通过浓硫酸 | D. | 通过高锰酸钾溶液 |
17. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,△H<0(填“>”、“<”或“=”).
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
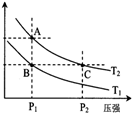
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
18.下列离子方程式书写正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氧化镁与稀盐酸混合:MgO+H+═Mg2++H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |