题目内容
6.食盐中通常添加碘酸钾来补充碘元素,我国规定食盐的含碘量(按每千克食盐含碘元素计)为20~40mg/kg,则每千克食盐中加入碘酸钾的质量应不少于(设碘酸钾的摩尔质量为M g•mol-1)( )| A. | $\frac{{20M×{{10}^{-3}}}}{127}$g | B. | 20M g | C. | $\frac{{20×{{10}^{-3}}}}{M}$g | D. | $\frac{20}{M}$g |
分析 1kg食盐中至少含碘元素20mg,根据n=$\frac{m}{M}$计算I元素物质的量,再根据I元素守恒确定每千克食盐加入碘酸钾(KIO3)的物质的量,最后根据m=nM计算出加入碘酸钾的质量.
解答 解:1kg食盐中至少含碘元素20mg,即含Ⅰ物质的量为:$\frac{20×1{0}^{-3}g}{127g/mol}$mol=$\frac{20×1{0}^{-3}}{127}$mol,则每千克食盐中碘酸钾的物质的量为:n(KIO3)=n(I)=$\frac{20×1{0}^{-3}}{127}$mol,其质量为:$\frac{20×1{0}^{-3}}{127}$mol×Mg/mol=$\frac{20M×1{0}^{-3}}{127}$g,
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量之间的关系为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,△H<0(填“>”、“<”或“=”).
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
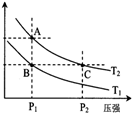
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
1.镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池.镍氢电池的总反应式是:H2+2NiO(OH) $?_{充电}^{放电}$ 2Ni(OH)2,据此反应判断,下列叙述中正确的是( )
| A. | 电池放电时,电池负极周围溶液的pH 不断增大 | |
| B. | 电池充电时,阳极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,负极反应为:H2-2e-═2H+ |
11.已知由AgNO3溶液和稍过量的KI溶液制得的AgI胶体,当它跟Fe(OH)3胶体相混合时,能析出AgI和Fe(OH)3的混合沉淀,由此可知( )
| A. | 该AgI胶粒带正电荷 | |
| B. | 该AgI胶体带负电荷 | |
| C. | 该AgI胶体进行电泳时,胶粒向阳极移动 | |
| D. | 该AgI胶体是电解质 |
18.下列离子方程式书写正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氧化镁与稀盐酸混合:MgO+H+═Mg2++H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
15.下列说法中正确的是( )
| A. | 相同温度下,同浓度的溶液的pH:CH3COONa>Na2CO3>NaHCO3>NaClO | |
| B. | 同温同浓度的三种溶液:①(NH4)2SO4②(NH4)2CO3③(NH4)2FeSO4 c (NH4+)大小:②>①>③ | |
| C. | 室温时pH=8的NaOH溶液与pH=8的氨水等体积混合pH等于8 | |
| D. | 向1mL0.1mol/L AgNO3溶液中滴加3~5滴0.1mol/L NaCl溶液,产生白色沉淀,再滴入KI溶液,沉淀变成黄色,由此推出:Ksp(AgI)<Ksp(AgCl) |
16.向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,经洗涤、干燥、灼烧,得到黑色固体质量为32g.下列有关说法不正确的是( )
| A. | 原混合物中含氧原子的质量为1.6g | |
| B. | 原硝酸的物质的量浓度为2.0mol/L | |
| C. | 反应中产生标况下NO的体积为4.48L | |
| D. | 固体物质溶解后剩余HNO3为0.2mol |
