题目内容
8.随着科技的不断进步,15N、N70、N5+、NH5等已被发现.下列有关说法中,正确的是( )| A. | 15N中含有7个中子 | |
| B. | N2和N70属于同位素 | |
| C. | N5+中含有36个电子 | |
| D. | 若NH5为离子化合物,则其既含有离子键,又含有共价 |
分析 A.质子数+中子数=质量数;
B.质子数相同中子数不同的同种元素的不同原子为同位素;
C.阳离子是失去一个电子形成;
D.氢离子和铵根离子间存在离子键,铵根离子中氮原子和氢原子间存在共价键;
解答 解:A.15N中含有中子数=15-7=8,故A错误;
B.N2和N70属于氮元素的同素异形体,同位素是原子,故B错误;
C.N5+中含有电子数=5×7-1=34,故C错误;
D.化学式为NH5,是氢离子和铵根离子间形成的离子化合物,存在离子键,铵根离子中氮原子和氢原子间存在共价键,故D正确;
故选D.
点评 本题考查了原子结构、微粒数关系、物质构成等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
18.下列离子方程式书写正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氧化镁与稀盐酸混合:MgO+H+═Mg2++H2O | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
19.在硫化钠溶液中存在的下列关系不正确的是( )
| A. | C(Na+)=2C(S2-)+2C(HS-)+2C(H2S) | B. | C(Na+)+C(H+)=C(OH-)+C(HS-)+C(S2-) | ||
| C. | C(OH-)=C(H+)+C(HS-)+2(H2S) | D. | C(Na+)>C(S2-)>C(OH-)>C(HS-) |
16.向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,经洗涤、干燥、灼烧,得到黑色固体质量为32g.下列有关说法不正确的是( )
| A. | 原混合物中含氧原子的质量为1.6g | |
| B. | 原硝酸的物质的量浓度为2.0mol/L | |
| C. | 反应中产生标况下NO的体积为4.48L | |
| D. | 固体物质溶解后剩余HNO3为0.2mol |
3.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
| A. | 检验自来水中是否含Cl- | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 鉴别AgNO3 溶液和BaCl2 溶液 | D. | 除去热水瓶内壁上的水垢 |
20.下列物质属于天然纤维的是( )
| A. | 粘胶纤维 | B. | 涤纶 | C. | 丙纶 | D. | 木材 |
6.下列关于沉淀溶解平衡的说法正确的是( )
| A. | Ksp(AB2)小于Ksp(CD),则化合物AB2的溶解度一定小于化合物CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的溶解度增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
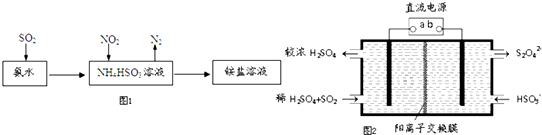 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.