题目内容
17.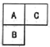 短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.
短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.(1)B的元素符号是Si,其含氧酸的化学式是H2SiO3.
(2)C在元素周期表中位于第二周期、第ⅤA族,C单质的电子式是
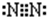 .
.(3)A与C相比,非金属性强的是N(填元素符号),能证明该结论的一个化学反应是(写化学方程式)2HNO3+Na2CO3=2NaNO3+H2O+CO2↑.
分析 短周期元素A、B、C在元素周期表中的位置关系如图所示,则A、C位于第二周期,B位于第三周期,设A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+1,根据“B元素原子的核外电子数等于C元素原子序数的2倍”可知:x+8=2(x+1),解得:x=6,则A为C元素、B为Si元素、C为N元素,据此结合元素周期律知识进行解答.
解答 解:短周期元素A、B、C在元素周期表中的位置关系如图所示,则A、C位于第二周期,B位于第三周期,设A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+1,根据“B元素原子的核外电子数等于C元素原子序数的2倍”可知:x+8=2(x+1),解得:x=6,则A为C元素、B为Si元素、C为N元素,
(1)B为的元素符号为Si,其含氧酸为硅酸,化学式为:,
故答案为:Si;H2SiO3;
(2)C为N元素,原子序数为7,位于周期表中第二周期、第ⅤA族,氮气的电子式为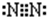 ,
,
故答案为:二;ⅤA;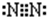 ;
;
(3)A为C元素、C为Si元素,非金属性越强,最高价氧化物对应的水合物的酸性越强,根据反应2HNO3+Na2CO3=2NaNO3+H2O+CO2↑可知酸性:HNO3>H2CO3,则非金属性:N>C,
故答案为:N;2HNO3+Na2CO3=2NaNO3+H2O+CO2↑.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列反应能说明卤素的活泼性顺序的是( )
①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2.
①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
5.下列粒子中,与H2O具有相同电子数的是( )
| A. | N2 | B. | S2- | C. | NH4+ | D. | HCl |
12.下列关于碱金属的叙述中,正确的是( )
| A. | K燃烧时生成K2O | B. | Cs位于元素周期表的第五周期 | ||
| C. | 与水反应的剧烈程度Li>Na>K | D. | 单质的熔点高低顺序Li>Na>K |
2.常温下,某酸HA的电离常数Ka=1×10-5,下列说法正确的是( )
| A. | 向HA溶液中逐滴加入少量NH3•H2O,$\frac{c({H}^{+})}{c({A}^{-})}$逐渐增大 | |
| B. | 常温下,0.1mol•L-1 HA溶液中水电离的c(H+)为10-13mol•L-1 | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol•L-1 NaA溶液水解常数为10-9 |
9.某些建筑材料含有放射性元素${\;}_{86}^{222}$Rn(氡),会对人体产生危害.下列说法不正确的是( )
| A. | 中子数是136 | B. | 质量数222 | C. | 电子数86 | D. | 质子数136 |
6.从下列事实中所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将等浓度的盐酸、碳酸氢钠两溶液混合反应,产生CO2气体 | 非金属性:Cl>C |
| ② | 将燃烧的镁条放入CO2中能继续燃烧,产物有C | 还原性:Mg>C |
| ③ | MgCl2、AlCl3溶液中分别加入过量氨水,均产生白色沉淀 | 金属性:Mg>Al |
| ④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ③④ | B. | ②④ | C. | ①② | D. | 全部 |

 ,在流程中作反应的催化剂;
,在流程中作反应的催化剂; ;
; .
. .
. 、CH3NHCOOH或CH3N=C=O.
、CH3NHCOOH或CH3N=C=O. .
. )是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用):
)是合成抗病毒药物阿昔洛韦的中间体.参照上述合成路线,写出以1,3-丁二烯为原料制备H的合成路线流程图(无机试剂任用):
 .
. 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.