题目内容
6.从下列事实中所得出的相应结论正确的是( )| 实验事实 | 结论 | |
| ① | 将等浓度的盐酸、碳酸氢钠两溶液混合反应,产生CO2气体 | 非金属性:Cl>C |
| ② | 将燃烧的镁条放入CO2中能继续燃烧,产物有C | 还原性:Mg>C |
| ③ | MgCl2、AlCl3溶液中分别加入过量氨水,均产生白色沉淀 | 金属性:Mg>Al |
| ④ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ③④ | B. | ②④ | C. | ①② | D. | 全部 |
分析 ①非金属的非金属性越强,其最高价含氧酸的酸性越强;
②还原剂还原性大于还原产物;
③金属的金属性越强,其最高价氧化物的水化物碱性越强;
④能使湿润红色石蕊试纸变蓝的气体为氨气.
解答 解:①非金属的非金属性越强,其最高价含氧酸的酸性越强,盐酸是无氧酸,故①错误;
②由还原剂还原性大于还原产物可知将燃烧的镁条放入CO2中能继续燃烧,还原性:Mg>C,故②正确;
③金属的金属性越强,其最高价氧化物的水化物碱性越强,氯化镁和氯化铝溶液分别和氨水混合都生成白色沉淀,不能鉴别氢氧化镁、氢氧化铝碱性强弱,所以不能判断镁、铝的金属性强弱,故③错误;
④能使湿润红色石蕊试纸变蓝的气体为氨气,可说明溶液一定有NH4+,故正确.
所以正确的有②④;
故选B.
点评 本题考查化学实验方案的评价,涉及非金属性、金属性、氧化性的比较以及离子的检验,为高考常见题型,综合考查学生的实验评价和分析能力,题目难度不大,注意把握相关物质的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列各组物质的晶体中,化学键类型完全相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | NaCl和HCl | C. | H2O和H2 | D. | KOH和KCl |
1.下列叙述中正确的是( )
| A. | 在多电子的原子里,能量高的电子通常顺离核近的区域内运动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了K层后才排L层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
15.下列分散系中的分散质粒子大小属于纳米级(1-100nm)的是( )
| A. | Fe(OH)3胶体 | B. | Fe(OH)3沉淀 | C. | FeCl3溶液 | D. | 油水混合物 |
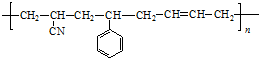 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.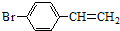 )需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.
)需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.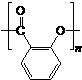 .
.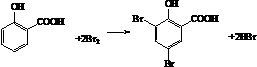 .
.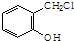 制备A的合成路线
制备A的合成路线 短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.
短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍. .
.
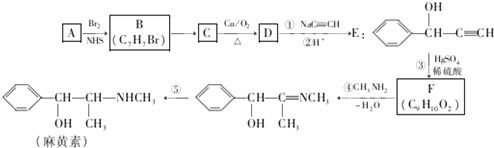
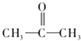
 .
. .
.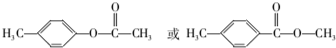 .
. 的合成路线,其它试剂及溶剂任选.
的合成路线,其它试剂及溶剂任选.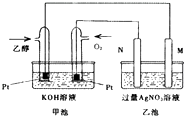 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: