题目内容
7.下列反应能说明卤素的活泼性顺序的是( )①2HClO4+Br2(g)═2HBrO4+Cl2
②2NaBr+Cl2═NaCl+Br2
③2KI+Cl2═2KCl+I2④2KI+Br2═2KBr+I2.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
分析 元素的非金属性越活泼,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,据此判断.
解答 解:元素的非金属性越活泼,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,
①反应2HClO4+Br2(g)=2HBrO4+Cl2得出还原性顺序是:Br2>Cl2;
②2NaBr+Cl2=2KCl+Br2得出氧化性顺序是:Cl2>Br2;
③2KI+Cl2=2KCl+I2得出氧化性顺序是:Cl2>I2;
④2KI+Br2=2KBr+I2得出氧化性顺序是:Br2>I2;
根据反应②③④即可得出氧化性顺序是:Cl2>Br2>I2,即卤素的非金属性活泼顺序是Cl>Br>I;
故选C.
点评 本题以卤族元素为载体考查非金属元素非金属性强弱判断,明确非金属性强弱与其单质氧化性强弱关系是解本题关键,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
18.如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
2.元素性质呈周期性变化的决定因素是( )
| A. | 元素相对原子质量依次递增 | |
| B. | 元素原子半径呈周期性变化 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
12.下列有机物有顺反异构体的是( )
| A. | CH3CH3 | B. | CH2=CH2 | C. | CH3CH=CHCl | D. | CH3CH=CH2 |
19.下列说法中,正确的是( )
| A. | 仅由碳元素组成的物质一定是纯净物 | |
| B. | 金刚石、石墨、足球烯(C60)互为同素异形体 | |
| C. | 同素异形体之间的转化属于物理变化 | |
| D. | 金刚石和石墨的性质完全相同 |
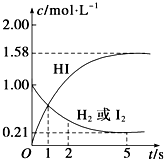 某温度时,向某V L的密闭容器中充入3mol
某温度时,向某V L的密闭容器中充入3mol
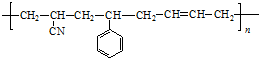 除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.
除苯乙烯外,还需要另外两种单体,写出这两种单体的结构简式CH2=CH-CN、CH2=CH-CH=CH2.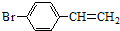 )需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.
)需要三步,第一步选用的试剂为HBr,目的是保护碳碳双键防止被加成.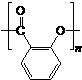 .
.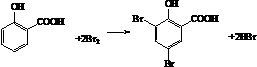 .
.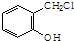 制备A的合成路线
制备A的合成路线 短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.
短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍. .
.