题目内容
12.下列关于碱金属的叙述中,正确的是( )| A. | K燃烧时生成K2O | B. | Cs位于元素周期表的第五周期 | ||
| C. | 与水反应的剧烈程度Li>Na>K | D. | 单质的熔点高低顺序Li>Na>K |
分析 A.K是活泼金属弱酸生成产物是过氧化钾、超氧化钾;
B.Cs元素是55号元素位于第六周期;
C.同主族从上到下金属性依次增强,与水反应剧烈程度增加;
D.同主族单质的熔点依次降低;
解答 解:A.K是活泼金属燃烧生成产物是过氧化钾、超氧化钾,故A错误;
B.Cs元素是55号元素,有六个电子层位于周期表中的第六周期,故B错误;
C.同主族从上到下金属性依次增强,与水反应剧烈程度增加,与水反应的剧烈程度Li<Na<K,故C错误;
D.同主族单质的熔点依次降低,单质的熔点高低顺序Li>Na>K,故D增强;
故选D.
点评 本题考查了碱金属性质、同主族递变规律、周期表结构等知识点,题目难度中等.

练习册系列答案
相关题目
2.元素性质呈周期性变化的决定因素是( )
| A. | 元素相对原子质量依次递增 | |
| B. | 元素原子半径呈周期性变化 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
3.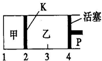 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 | |
| C. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小 | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
20.下列电池中,对环境友好的是( )
| A. |  锌锰干电池 | B. |  铅蓄电池 | C. |  氢燃料电池 | D. |  镍镉电池 |
7.对于反应3C=A+2B,以下化学反应速率中最快的是( )
| A. | v(B)=0.8mol/(L•s) | B. | v(A)=0.6mol/(L•s) | C. | v(C)=0.9mol/(L•s) | D. | v(B)=1.0mol/(L•s) |
4.某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )


| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 该物质可与H2反应,1mol该物质最多消耗5mol H2反应 |
1.下列叙述中正确的是( )
| A. | 在多电子的原子里,能量高的电子通常顺离核近的区域内运动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了K层后才排L层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
2.下列判断正确的是( )
| A. | 沸点:CH4>NH3>H2O | B. | 得电子能力:C>N>O | ||
| C. | 酸性:H2SO4>HClO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.
短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍. .
.