题目内容
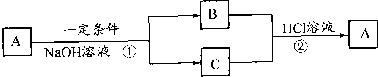
下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4.

请回答下列问题:
(1)写出下列反应的化学方程式:反应⑤ .反应⑦ .
(2)N2H4是强还原剂,与氧化剂反应时放出大量的热,如N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ/mol.因此,N2H4可以作为火箭的推进剂.据此,你认为在常温下,氮气和水蒸气 (填“能”或“不能”)自发反应生成N2H4(l)和H2O2(l),原因是 .
(3)电解A溶液的过程中,如在阳极产生C、E气体的体积均为2.24L(标准状况),则在阴极产生气体的体积(标准状况)为 .

请回答下列问题:
(1)写出下列反应的化学方程式:反应⑤
(2)N2H4是强还原剂,与氧化剂反应时放出大量的热,如N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642.2kJ/mol.因此,N2H4可以作为火箭的推进剂.据此,你认为在常温下,氮气和水蒸气
(3)电解A溶液的过程中,如在阳极产生C、E气体的体积均为2.24L(标准状况),则在阴极产生气体的体积(标准状况)为
考点:无机物的推断
专题:推断题
分析:根据图示,J为单质E、F合成的化合物,所以J为过氧化钠,则E为氧气、F为金属钠;O为红褐色的氢氧化铁,K为含有铁元素的化合物,I、D为单质,所以I为铁单质,D为氢气,H为氯化氢,C为氯气,K为硫化亚铁;根据C、D分别为氯气、氢气可知A为氯化钠,则B为氢氧化钠,氯气与氢氧化钠反应生成了氯化钠和G次氯酸钠,据此完成本题解答.
解答:
解:由框图中电解A的稀溶液以及一些常见物质间的转化关系及J为单质E、F合成的化合物,可知J为淡黄色的过氧化钠,由于E为气体,则E为氧气、F为金属钠;O为红褐色的氢氧化铁,则K为含有铁元素的化合物,I、D为单质,I与H的反应为置换反应,所以I为铁单质,D为氢气,H为氯化氢,C为氯气,K为铁与盐酸反应生成的氯化亚铁;根据C、D分别为氯气、氢气及各物质都是常见物质可知A为氯化钠,则B为氢氧化钠,氯气与氢氧化钠反应生成了氯化钠和G次氯酸钠,
(1)反应⑤为次氯酸钠与氨气反应生成氯化钠、肼和水,反应的化学方程式为:NaClO+2NH3=NaCl+N2H4+H2O;反应⑦为过氧化钠与氯化亚铁反应生成氢氧化铁、氯化钠和氧气,反应的化学方程式为:4Na2O2+4FeCl2+6H2O=4Fe(OH)3↓+8NaCl+O2↑,
故答案为:NaClO+2NH3=NaCl+N2H4+H2O;4Na2O2+4FeCl2+6H2O=4Fe(OH)3↓+8NaCl+O2↑;
(2)△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的逆反应的△H>0、△S<0,△H-T△S>0,行反应不能自发进行,
故答案为:不能;N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的逆反应的△H>0、△S<0,反应不能自发进行;
(3)C为氯气、E为氧气,标况下2.24L气体的物质的量为0.1mol,生成0.1mol氯气和0.1mol氧气失去的电子的物质的量为:0.1mol×2+0.1mol×4=0.6mol,根据电荷守恒,阴极得到电子的物质的量为0.6mol,阴极生成的是氢气,由生成1mol氢气得到2mol电子可知,转移0.6mol电子生成了0.3mol氢气,标况下0.3mol氢气的体积为约6.72L,
故答案为:6.72 L.
(1)反应⑤为次氯酸钠与氨气反应生成氯化钠、肼和水,反应的化学方程式为:NaClO+2NH3=NaCl+N2H4+H2O;反应⑦为过氧化钠与氯化亚铁反应生成氢氧化铁、氯化钠和氧气,反应的化学方程式为:4Na2O2+4FeCl2+6H2O=4Fe(OH)3↓+8NaCl+O2↑,
故答案为:NaClO+2NH3=NaCl+N2H4+H2O;4Na2O2+4FeCl2+6H2O=4Fe(OH)3↓+8NaCl+O2↑;
(2)△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的逆反应的△H>0、△S<0,△H-T△S>0,行反应不能自发进行,
故答案为:不能;N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的逆反应的△H>0、△S<0,反应不能自发进行;
(3)C为氯气、E为氧气,标况下2.24L气体的物质的量为0.1mol,生成0.1mol氯气和0.1mol氧气失去的电子的物质的量为:0.1mol×2+0.1mol×4=0.6mol,根据电荷守恒,阴极得到电子的物质的量为0.6mol,阴极生成的是氢气,由生成1mol氢气得到2mol电子可知,转移0.6mol电子生成了0.3mol氢气,标况下0.3mol氢气的体积为约6.72L,
故答案为:6.72 L.
点评:本题考查了无机物的推断,题目难度中等,试题涉及了离子方程式的书写、判断反应能否自发等知识点,正确推断物质是解本题关键,以物质的特殊性质为突破口采用正逆相结合的方法推断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、1 L 0.5mol?L-1 MgCl2溶液所含Cl-数为NA |
| B、标准状况下,22.4 L水所含分子数为NA |
| C、常温常压下,22.4 LCO2所含的分子数为NA |
| D、64 g铜在足量氯气中完全燃烧,转移的电子数为NA |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、22.4LCl2中含有NA个Cl2分子 |
| B、1L O.1mol.L-1Na2SO4溶液中有 0.1NA个 Na+ |
| C、1 molH2 与 1 molCl2应生成 NA个 HCl 分子 |
| D、1 molCa变成Ca2+时失去的电子数为2NA |
下列反应不能用CO3 2-+3H+═CO2↑+H2O来表示的是( )
| A、Na2CO3+HCl |
| B、BaCO3+HCl |
| C、K2CO3+HNO3 |
| D、Na2CO3+H2SO4 |
 A为用惰性电极电解饱和食盐水的装置.
A为用惰性电极电解饱和食盐水的装置.