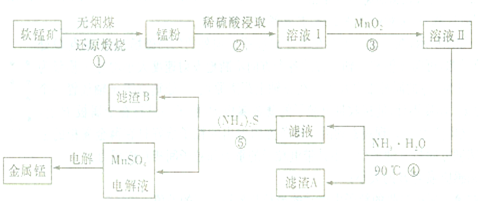
题目内容
3.下表是25℃时某些弱酸的电离平常数,下列说法正确的是( )| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.NaClO水解程度较大,溶液中氢离子浓度较小,结合电荷守恒判断;
B.根据强酸制取弱酸判断;
C.根据HClO酸性较CH3COOH弱,则pH相同、体积相等的HClO和CH3COOH溶液,HClO的浓度大分析;
D.酸的电离常数越大,则酸根离子的水解程度越小.
解答 解:A.HClO酸性较弱,NaClO水解程度较大,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)、c(Na+)+c(H+)=c(OH-)+c(ClO-),由于NaClO水解程度较大,溶液中氢离子浓度较小,且两溶液钠离子浓度相等,所以CH3COONa溶液中离子总数大于NaClO溶液,故A错误;
B.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.因为HClO酸性较CH3COOH弱,则pH相同、体积相等的HClO和CH3COOH溶液,HClO的浓度大,所以用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大,故C正确;
D.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故D错误.
故选C.
点评 本题考查电解质的强弱与电离常数的关系,为高频考点,侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键,难度中等.

练习册系列答案
相关题目
13.某研究小组通过实验探究Al、Fe、Cu及其化合物的性质,操作正确且能达到实验目的是( )
| A. | 将铝、铜、铁片插入浓硫酸,以证明常温下Al、Fe、Cu能否与浓硫酸反应 | |
| B. | 加过量NaOH溶液,过滤弃去沉淀,以除去混在Al2O3中的Fe2O3 | |
| C. | 将铁器、铜器放入盐酸中浸泡,以除去表面的铁锈和铜绿[Cu2(OH)2CO3] | |
| D. | 将FeCl3、CuCl2溶液在蒸发皿中加热蒸干,以制得FeCl3、CuCl2固体 |
14.下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
| A. | H2 | B. | Cl2 | C. | NaH | D. | HF |
11.下列实验装置或操作能达到目的且现象描述正确的是( )

| A. | 装置①:制取乙炔并验证炔烃的性质;溴水褪色 | |
| B. | 装置②:检验乙醇的氧化性;溶液颜色从绿色变成橙色 | |
| C. | 装置③:验证葡萄糖分子中含有醛基官能团;出现银镜 | |
| D. | 装置④:验证碳酸的酸性比苯酚的酸性强;溶液变浑浊 |
18.下列图示与对应的叙述相符的是( )
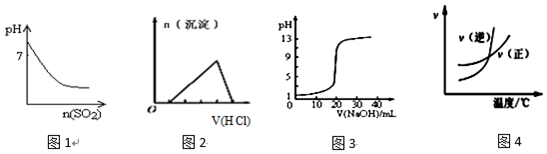

| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |
8. 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )| A. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后逐渐由黄色变为橙色,是因为阳极取H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 通电阳离子交换膜的离子主要是H+离子 |
2.在实验室里,钠应保存在煤油中的原因是( )
①Na易与O2反应
②Na易与N2反应
③Na易与H2O反应
④Na的密度小于H2O
⑤Na不与煤油反应
⑥煤油比钠的密度小,钠放入其中可与空气隔绝.
①Na易与O2反应
②Na易与N2反应
③Na易与H2O反应
④Na的密度小于H2O
⑤Na不与煤油反应
⑥煤油比钠的密度小,钠放入其中可与空气隔绝.
| A. | ①②③ | B. | ③④⑥ | C. | ①④⑤ | D. | ①③⑤⑥ |
3.元素X与元素Y在周期表中位于相邻的两个周期,X与Y两原子核外电子数之和为19,Y原子核内质子数比X多3个.下列描述正确的是( )
| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式可能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类少 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |