题目内容
3.元素X与元素Y在周期表中位于相邻的两个周期,X与Y两原子核外电子数之和为19,Y原子核内质子数比X多3个.下列描述正确的是( )| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式可能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类少 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
分析 元素X和元素Y在周期表中位于相邻的两个周期:X与Y两原子核外电子总数之和为19,则为短周期元素,且位于二、三周期,设X原子的质子数为m,Y原子的质子数为n,则有:$\left\{\begin{array}{l}{m+n=19}\\{n-m=3}\end{array}\right.$,解之得m=8,n=11,所以X为O元素,Y为Na元素,根据元素对应的单质、化合物的结构和性质解答该题.
解答 解:由以上分析可知X为O元素,Y为Na元素,
A.X为O元素,氧气在自然界可以单质存在,故A错误;
B.O钠在氧气中燃烧可生成Na2O2,故B正确;
C.O元素可存在于氧化物、盐、碱以及有机物中,化合物种类繁多,故C错误;
D.钠与盐溶液反应时首先与水反应生成氢氧化钠与氢气,在熔融状态下可置换出金属,故D错误.
故选B.
点评 本题考查元素的推断和元素化合物的性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意D选项熔融状态下钠与盐反应置换金属.

练习册系列答案
相关题目
3.下表是25℃时某些弱酸的电离平常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
11.把VL含有硫酸镁和硫酸铝的混合溶液分成两等份,一份加入含有amol氢氧化钠溶液,恰好使铝离子完全转化为偏铝酸根离子(1mol铝离子消耗4摩尔氢氧化钠生成1摩尔偏铝酸根离子);另一份加入含有bmol氯化钡溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中镁离子的浓度为( )
| A. | $\frac{8b-3a}{2v}$mol/L | B. | $\frac{8b-3a}{4v}$mol/L | C. | $\frac{8b-3a}{v}$mol/L | D. | $\frac{a-2b}{2v}$mol/L |
18.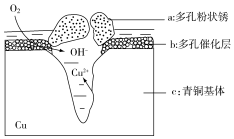 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
8.下列离子方程式式书写正确的是( )
| A. | 向偏铝酸钠溶液中滴加碳酸氢钠溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | Fe(NO3)3溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 酸性KMnO4溶液与H2O2反应证明H2O2具有还原性:MnO4-+10H++H2O2═2Mn2++6H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
 可简写为
可简写为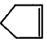 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: