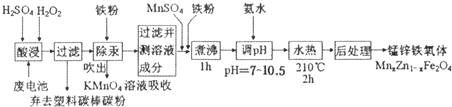
题目内容
5.用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下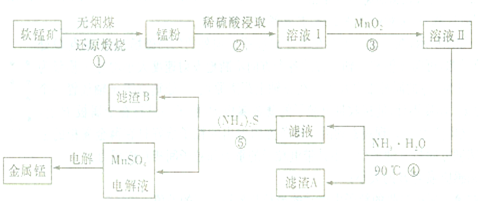
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为MnO2+C$\frac{\underline{\;高温\;}}{\;}$MnO+CO2↑.
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:MnO2>Cl2>Fe3+.
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O.
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-24,要使滤渣A沉淀完全,需用氨水调pH至少为6.3(已知lg3≈0.5).
(5)滤渣B的主要成分为CuS、HgS.
(6)(NH4)2S溶液中显电中性微粒有4种.
(7)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为MnO42--e-=MnO4-.
分析 用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4:与无烟煤反应生成锰粉(要成分为MnO):MnO2+C$\frac{\underline{\;高温\;}}{\;}$MnO+CO2↑,加入稀硫酸浸取,溶液I中含有Mn2+、Cu2+、Hg2+、Fe2+,加入二氧化锰氧化亚铁离子为铁离子,MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O,溶液II中含有Mn2+、Cu2+、Hg2+、Fe3+,加入一水合氨沉淀铁离子,滤渣A为Fe(OH)3,向滤液(Mn2+、Cu2+、Hg2+)中加入硫化氨,沉淀Cu2+、Hg2+,滤渣B为CuS、HgS,得到硫酸锰溶液,电解硫酸锰得到锰单质,据此分析解答.
解答 解:(1)根据分析反应①为软锰矿与无烟煤反应生成锰粉(要成分为MnO):MnO2+C$\frac{\underline{\;高温\;}}{\;}$MnO+CO2↑;
故答案为:MnO2+C$\frac{\underline{\;高温\;}}{\;}$MnO+CO2↑;
(2)实验室可用软锰矿与浓盐酸反应制Cl2,根据氧化性强的物质制备氧化性若的物质,MnO2>Cl2,氯气将亚铁氧化为铁离子,则Cl2>Fe3+,故MnO2、C12、Fe3+的氧化性强弱MnO2>Cl2>Fe3+;
故答案为:MnO2>Cl2>Fe3+;
(3)MnO2有氧化性,将Fe2+氧化为铁离子,反应为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;
故答案为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;
(4)滤渣A为Fe(OH)3,已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-24,要使滤渣A沉淀完全,则c(OH-)=$\root{3}{\frac{6.4×1{0}^{-24}}{1×1{0}^{-5}}}$mol/L=4×10-20/3mol/L,c(H+)=$\frac{3.6×1{0}^{-13}}{4×1{0}^{-20/3}}$mol/L=9×10-22/3mol/L,则pH为6.3;
故答案为:6.3;
(5)滤液(Mn2+、Cu2+、Hg2+)中加入硫化氨,沉淀Cu2+、Hg2+,滤渣B为CuS、HgS;
故答案为:CuS、HgS;
(6)(NH4)2S溶液中显电中性微粒有NH3、NH3•H2O、H2O、H2S,共四种;
故答案为:4;
(7)用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极失去电子发生氧化反应,为锰酸钾发生氧化反应生成高锰酸钾,反应式为MnO42--e-=MnO4-;
故答案为:MnO42--e-=MnO4-.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算、电解原理等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 丁烷 | B. | 2-甲基丙烷 | C. | 1-甲基丙烷 | D. | 甲烷 |
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| A. | 23gNa与氧气充分燃烧,转移的电子数为NA | |
| B. | 1mol甲醇中含有的共价键数为4NA | |
| C. | 46gNO2和N2O4的混合气体含有的原子数为2NA | |
| D. | 标准状况下,22.4L氨水含有NH3分子数为NA |
 氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.
氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.