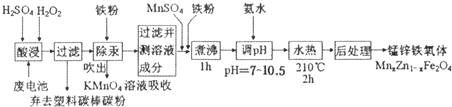
题目内容
8. 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )| A. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后逐渐由黄色变为橙色,是因为阳极取H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 通电阳离子交换膜的离子主要是H+离子 |
分析 A、阴极上得电子发生还原反应,氢离子放电;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、将阳极室、阴极室发生的反应加合可得总的反应式,注意阴极室还发生反应2CrO42-+2H+═Cr2O72-+H2O;
D、阴极室还发生反应2CrO42-+2H+═Cr2O72-+H2O,氢离子被消耗,而阳极区产生氢氧根离子,与阴极转移的钾离子结合生成氢氧化钾.
解答 解:A、电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极反应为:2H2O+2e-═2OH-+H2↑,故A正确;
B、阳极室发生氧化反应,水失去电子放电,电极反应为:2H2O-4e-=4H++O2↑,阳极区氢离子浓度增大,平衡右移,溶液逐渐由黄色变为橙色,故B正确;
C、阴极电极反应为:4H2O+4e-=4OH-+2H2↑,阳极反应为:2H2O-4e-=4H++O2↑,4CrO42-+4H+═2Cr2O72-+2H2O,故总制备方程式为4K2CrO4 +4H2O $\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、阴极室还发生反应2CrO42-+2H+═Cr2O72-+H2O,氢离子被消耗,而阳极区产生氢氧根离子,与阴极转移的钾离子结合生成氢氧化钾,所以通电阳离子交换膜的离子主要是K+离子,故D错误;
故选D.
点评 本题考查了电解原理,根据阴阳极上发生的反应类型写出相应的电极反应式,其中阴极存在CrO42-和Cr2O72-的转化,有一定的难度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列说法是否正确( )
①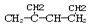 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯
②相对分子质量相同的两种有机物一定是同分异构体
③烯烃各同系物中碳的质量分数都相等
④从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
⑤在相同条件下,燃烧等质量的C2H4和苯,乙烯消耗O2的量多
⑥苯乙炔中最多有6个原子在同一条直线上.
①
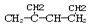 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯②相对分子质量相同的两种有机物一定是同分异构体
③烯烃各同系物中碳的质量分数都相等
④从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
⑤在相同条件下,燃烧等质量的C2H4和苯,乙烯消耗O2的量多
⑥苯乙炔中最多有6个原子在同一条直线上.
| A. | 都不正确 | B. | ③⑤⑥正确 | C. | ②④⑥正确 | D. | ①③⑥正确 |
19.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO;其原料为锌、电解液和空气,则下列叙述不正确的是( )
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |
16.某温度下,下列溶液的离子浓度关系式正确的是( )
| A. | 0.1 mol/L 的硫酸铵溶液中:c(NH4+)>c(SO42?)>c(H+)>c(OH?) | |
| B. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(OH?)+c(HCO3?)+2c(H2CO3) | |
| C. | pH之和为14的H2C2O4与KOH 溶液混合:c(K+)>c(H+)>c(OH?)>c(HC2O4?) | |
| D. | pH=5 的H2S溶液中,c(H+)>c(HS?)=1×10-5mol/L |
3.下表是25℃时某些弱酸的电离平常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
8.下列离子方程式式书写正确的是( )
| A. | 向偏铝酸钠溶液中滴加碳酸氢钠溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | Fe(NO3)3溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 酸性KMnO4溶液与H2O2反应证明H2O2具有还原性:MnO4-+10H++H2O2═2Mn2++6H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |