题目内容
14.下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )| A. | H2 | B. | Cl2 | C. | NaH | D. | HF |
分析 σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成为s-pσ键,则原子的成键电子为s电子、p电子,以此来解答.
解答 解:A.H的最外层电子为s电子,则只有s-sσ键,故A不选;
B.Cl的最外层为p电子,则只有p-pσ键,故B不选;
C.氢化钠是离子化合物,通过离子键形成的化合物,故C不选;
D.H的最外层电子为s电子,F的最外层为p电子,则只有s-pσ键,故D选;
故选D.
点评 本题考查共价键的形成,为高频考点,侧重分子结构与性质的考查,注意最外层电子的判断与共价键类型的关系即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列有关化学键的叙述,正确的是( )
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |
5.有机物E的名称是( )
| A. | 丁烷 | B. | 2-甲基丙烷 | C. | 1-甲基丙烷 | D. | 甲烷 |
2.铁粉、铜粉混合物样品11.6g,逐步加入2.0mol/L,的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如表:
请回答:
(1)样品中铁与铜的物质的量之比n(Fe):n(Cu)=3:1.
(2)在反应后的体系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反应后溶液中存在的各金属离子的物质的量分别是多少?
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
(1)样品中铁与铜的物质的量之比n(Fe):n(Cu)=3:1.
(2)在反应后的体系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反应后溶液中存在的各金属离子的物质的量分别是多少?
9.下列各化合物的命名中正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | CH3-CH2-CH=CH2 3-丁烯 | ||
| C. | 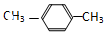 ,对二甲苯 ,对二甲苯 | D. | 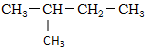 ,3-甲基丁烷 ,3-甲基丁烷 |
19.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO;其原料为锌、电解液和空气,则下列叙述不正确的是( )
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |
3.下表是25℃时某些弱酸的电离平常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
 氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.
氨基乙酸铜分子结构如图,碳原子的杂化方式为sp3、sp2,基态碳原子核外电子有6个空间运动状态.