题目内容
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图: ;D、E、F三种元素的第一电离能大小顺序为: (用元素符号表示).
(2)FD2中F原子的杂化类型为 ;分子空间构型为 ;FD2易溶于水的原因可能是: (填入序号).①FD2与水极性相同 ②FD2可以与水反应
(3)由B元素形成的某种单质作电极,插入碱液中构成BA2D2的燃料电池,则该电池的负极电极反应式为 .
(4)化合物BA2D2蒸气293K时,理论测算密度为1.9g?L-1,实际密度为2.5g?L-1的原因是 .
(5)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为: .
(6)化合物M在碱性条件可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾).补充完整并配平该制备反应的化学方程式: + KNO3+ = K2FeO4+ KNO2+ H2O.
| 元 素 | 性 质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
(1)画出元素C的基态原子核外电子排布图:
(2)FD2中F原子的杂化类型为
(3)由B元素形成的某种单质作电极,插入碱液中构成BA2D2的燃料电池,则该电池的负极电极反应式为
(4)化合物BA2D2蒸气293K时,理论测算密度为1.9g?L-1,实际密度为2.5g?L-1的原因是
(5)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:
(6)化合物M在碱性条件可用于制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾).补充完整并配平该制备反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,A元素一种核素的原子核内不含中子,则A为H元素;B元素原子核外电子有6种不同运动状态,则B为碳元素;最高价氧化物的水化物与其氢化物可发生非氧化还原反应,则C为N元素;D单质之一为淡蓝色气体,可阻挡对人体有害的紫外线,则D为O元素;E在地壳中的含量位居第三,则E为Al;F在周期表中位于短周期,处于第三周期,基态原子M层成对电子数是未成对电子数的2倍,原子序数大于Al,故其原子核外电子排布为1s22s22p63s23p4,则F为S元素;G元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨,则G为Fe,据此解答各小题及即可.
解答:
解:依据分析可知:A为氢,B为碳,C为氮,D为氧,E为铝,F为硫,G为铁,
(1)C为N元素,基态原子核外电子排布图为: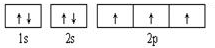 ;
;
同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能降低,故O、Al、S的第一电离能大小顺序为:O>S>Al,
故答案为: ;O>S>Al;
;O>S>Al;
(2)SO2中S原子的价层电子对数=2+
=3,S原子采取sp2杂化,S原子有1对孤电子对,分子空间构型为V形,SO2是极性分子,H2O是极性分子,根据相似相容原理可知由极性分子组成的溶质容易溶解于极性分子组成的溶剂中,此外SO2会和水发生反应SO2+H2O=H2SO3,反应不断消耗SO2也使它不断的溶解,因此SO2易溶于水,故答案为:sp2;V形;①②;
(3)由C元素形成的某种单质作电极,插入碱液中构成CH2O2(甲酸)的燃料电池,则该电池的负极是甲酸失去电子,在碱性溶液中二氧化碳变成碳酸根,故电极反应式为:HCOOH-2e-+4OH-=CO32-+3H2O,故答案为:HCOOH-2e-+4OH-=CO32-+3H2O;
(4)化合物CH2O2是甲酸,由于甲酸形成分子间氢键,实际密度大于理论测算密度,
故答案为:甲酸形成分子间氢键;
(5)有人推测化合物NH5的存在,应是NH4H,属于离子化合物,含有化学键应为:离子键、共价键,
故答案为:离子键、共价键;
(6)化合物M为Fe2O3,反应中Fe元素由+3价升高为+6价,共升高6价,N元素由+5价降低为+3价,共降低2价,化合价最小公倍数为6,故Fe2O3的系数为1、KNO3的系数为3,根据元素守恒可知,K2FeO4的系数为2,KNO2的系数为3,根据元素守恒可知,另外反应物为KOH,其系数为4,水的系数为2,故反应方程式为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3、KOH;Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
(1)C为N元素,基态原子核外电子排布图为:
 ;
;同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能降低,故O、Al、S的第一电离能大小顺序为:O>S>Al,
故答案为:
 ;O>S>Al;
;O>S>Al;(2)SO2中S原子的价层电子对数=2+
| 6-2×2 |
| 2 |
(3)由C元素形成的某种单质作电极,插入碱液中构成CH2O2(甲酸)的燃料电池,则该电池的负极是甲酸失去电子,在碱性溶液中二氧化碳变成碳酸根,故电极反应式为:HCOOH-2e-+4OH-=CO32-+3H2O,故答案为:HCOOH-2e-+4OH-=CO32-+3H2O;
(4)化合物CH2O2是甲酸,由于甲酸形成分子间氢键,实际密度大于理论测算密度,
故答案为:甲酸形成分子间氢键;
(5)有人推测化合物NH5的存在,应是NH4H,属于离子化合物,含有化学键应为:离子键、共价键,
故答案为:离子键、共价键;
(6)化合物M为Fe2O3,反应中Fe元素由+3价升高为+6价,共升高6价,N元素由+5价降低为+3价,共降低2价,化合价最小公倍数为6,故Fe2O3的系数为1、KNO3的系数为3,根据元素守恒可知,K2FeO4的系数为2,KNO2的系数为3,根据元素守恒可知,另外反应物为KOH,其系数为4,水的系数为2,故反应方程式为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3、KOH;Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
点评:本题考查比较综合,涉及元素的推断、核外电子排布、元素周期律、分子结构与性质、杂化轨道等,需要学生熟练掌握基础知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述正确的是( )
| A、氯化钠溶液能导电,所以氯化钠溶液是电解质 |
| B、氯化氢水溶液能导电,所以氯化氢是电解质 |
| C、三氧化硫溶于水能导电,所以三氧化硫是电解质 |
| D、CaCO3难溶于水,其水溶液几乎不导电,所以CaCO3为非电解质 |
我国“嫦娥Ⅱ号”成功进入月球轨道.月球土壤中吸附着数百万吨的32He,每百吨32He核聚变释放出的能量相当于目前人类一年消耗的能量.下列说法正确的是( )
| A、32He核聚变是化学变化 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、32He原子核内含有3个质子 |
 常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )
常温下,向20mL 0.1moL/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法不正确的是( )| A、a点表示的溶液中c(OH-)=10-11mol/L | ||
B、a、b点表示的溶液中
| ||
| C、c点表示CH3COOH和NaOH恰好完全反应 | ||
| D、d点表示的溶液中c(Na+)>c(CH3COO-) |


 分析下列两则信息,然后回答有关问题:
分析下列两则信息,然后回答有关问题: 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下: