题目内容
一种钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、I-等阴离子.某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色.
该同学最终确定在上述六种离子中含NO2-、CO32-、Cl-三种阴离子.请分析,该同学只需要完成上述哪几个实验,即可得出此结论( )
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色.
该同学最终确定在上述六种离子中含NO2-、CO32-、Cl-三种阴离子.请分析,该同学只需要完成上述哪几个实验,即可得出此结论( )
| A、①②④⑤ | B、③④ |
| C、③④⑤ | D、②③⑤ |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①用pH计测得溶液pH大于7,说明溶液呈碱性;
②加入盐酸,产生有色刺激性气体,说明溶液中含有NO2-;
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,说明溶液中含有Cl-、NO2-;
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,说明溶液含有CO32-,没有SO42-、SO32-;
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色,说明溶液中含有具有氧化性的离子NO2-、或SO32-.
②加入盐酸,产生有色刺激性气体,说明溶液中含有NO2-;
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,说明溶液中含有Cl-、NO2-;
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,说明溶液含有CO32-,没有SO42-、SO32-;
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色,说明溶液中含有具有氧化性的离子NO2-、或SO32-.
解答:
解:由实验④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,可知白色沉淀是BaCO3,气体是CO2,所以可以排除SO42-和SO32-;
实验③可以证明含有Cl-,由于要放出有色刺激性气体,所以只能是亚硝酸的自身分解,反应的方程式为:2HNO2═H2O+NO↑+NO2↑所以因此该同学只需要完成③④两个实验,即可得出此结论,选项B正确.
故选B.
实验③可以证明含有Cl-,由于要放出有色刺激性气体,所以只能是亚硝酸的自身分解,反应的方程式为:2HNO2═H2O+NO↑+NO2↑所以因此该同学只需要完成③④两个实验,即可得出此结论,选项B正确.
故选B.
点评:本题考查常见阴离子的检验,要掌握常见阴离子的检验方法,并会设计合理的实验.

练习册系列答案
相关题目
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:下列说法不正确的是( )
mCeO2
(m-x)CeO2?xCe+xO2
(m-x)CeO2?Ce+xH2O+xCO2
mCeO2+xH2+xCO.
mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?Ce+xH2O+xCO2
| 900℃ |
| ② |
A、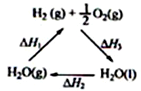 图中△H1=△H2+△H3 |
| B、该过程实现了太阳能向化学能的转化 |
| C、该过程中CeO2没有消耗 |
| D、H2O(l)=H2O(g)此过程中,△H>0 |
电解84.7mL质量分数为16%的氢氧化钠溶液(密度为1.18g?cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨为电极),这是因为( )
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
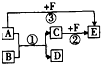 已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )
已知 A、B、D是三种常见的有机物,相同条件下,A 的蒸气对于H2的相对密度为 23,A 可以被氧化成 B,E 是密度最小的气体,它们之间有如图所示的转化关系(反应条件及部分产物未标出).下列说法中错误的是( )| A、A中的官能团是羟基 |
| B、反应①为取代反应,反应②为置换反应 |
| C、B能与CaCO3反应 |
| D、B与F不反应 |

