题目内容
15.将2.30gNa放入100gH2O中,所得溶液的密度为1.02g•cm-3,求该溶液物质的量浓度.(2Na+2H2O═2NaOH+H2↑)分析 将2.30gNa放入100gH2O中,发生反应得到氢氧化钠和氢气,计算溶质的质量分数,根据c=$\frac{1000ρw%}{M}$计算物质的量浓度.
解答 解:将2.30gNa放入100gH2O中,发生反应得到氢氧化钠和氢气2Na+2H2O═2NaOH+H2↑,可以得到氢氧化钠的质量是4.0g,产生氢气是0.1g,溶质的质量分数=$\frac{4.0g}{2.3g+100g-0.1g}$×100%=3.9%,该溶液物质的量浓度c=$\frac{1000×1.02×0.039}{40}$mol/L≈1.0mol/L,答:该溶液物质的量浓度是1.0mol/L.
点评 本题考查学生金属钠的化学性质以及物质的量浓度的计算知识,注意质量分数和物质的量浓度之间的关系是解题的关键.

练习册系列答案
相关题目
5.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 生石灰-Ca(OH)2 | B. | 小苏打-KHCO3 | C. | 重晶石-CaSO4 | D. | 醋酸-C2H4O2 |
6.某有机物M可以看成是丙烷分子中3个氢原子被醛基、羧基、溴原子三个官能团取代的产物.则M的结构有( )
| A. | 11种 | B. | 13种 | C. | 14种 | D. | 16种 |
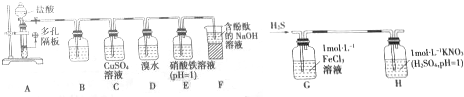
3. 常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )
常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )
 常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )
常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )| A. | 该方法为径向纸上层析法 | B. | 试样点需浸没于展开剂中 | ||
| C. | 试样点晾干或电风吹干后才能补滴 | D. | 喷浓氨水内层圆环色斑呈绛蓝色 |
10.要把100mL•12mol•L-1盐酸(密度为1.19g•cm-3)稀释成6mol•L-1盐酸(密度为1.10g•cm-3),需要加水的体积约为( )
| A. | 100mL | B. | 101mL | C. | 119mL | D. | 120mL |
10.等质量的下列有机物完全燃烧时,耗氧量最大的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
8.使用胆矾(CuSO4•5H2O)配制1L 0.2mol•L-1的硫酸铜溶液,正确的操作是( )
| A. | 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里 | |
| B. | 称取胆矾50 g,溶解在1 L水里 | |
| C. | 将32 g胆矾溶于水,然后将此溶液稀释至1 L | |
| D. | 将50 g胆矾溶于水,然后将此溶液稀释至1 L |
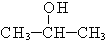 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O,产物不发生银镜反应;
+2H2O,产物不发生银镜反应; +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$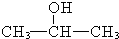 .
.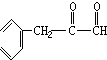 ,G与M是由不同方式形成的高分子化合物.
,G与M是由不同方式形成的高分子化合物.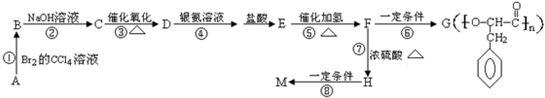
 .
.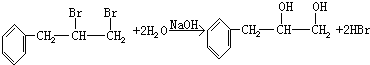 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.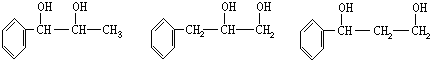
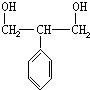 ,
,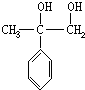 .
.