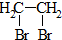题目内容
11.氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH.下列叙述中,不正确的是( )| A. | NaH的电子式为Na+[:H]- | |
| B. | NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作氧化剂 |
分析 A、NaH是离子化合物,阴离子是H-;
B、H-核外有2个电子;
C、电子排布相同时,原子序数越大,离子半径越小;
D、得电子的物质为氧化剂.
解答 解:A、NaH是离子化合物,阴离子是H-,NaH的电子式为Na+[:H]-,故A正确;
B、H-核外有2个电子,电子层排布与氦原子的电子层排布相同,故B正确;
C、电子排布相同时,原子序数越大,离子半径越小,则微粒半径H->Li+,故C错误;
D、NaH与H2O反应NaH+H2O=NaOH+H2↑,反应中水中的氢元素化合价降低,因此水做氧化剂,故D正确;
故选C.
点评 本题考查了电子式、电子排布、离子半径比较、氧化还原反应等,题目难度不大,侧重于基础知识的考查,注意把握离子半径的比较方法.

练习册系列答案
相关题目
2.利用如图所示装置进行相关实验能实现目标的是( )


| A. | 若I中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO2中是否混有CO2 | |
| B. | 若I中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO2和水蒸气的混合气体中水蒸气的含量 | |
| C. | 若I中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO2中混有的HCl | |
| D. | 若I中装BaCl2溶液,Ⅱ中装水,则能证明SO2和NO2混合气体中SO2不与BaCl2反应 |
6. 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式 .
.
③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
16.有一真空密闭容器中,盛有amolPCl5,加热到200℃时,发生如下反应PCl5(g)?PCl3(g)+Cl2(g),反应达平衡时,PCl5所占体积分数为M%,若在同一温度下,同一容器中,最初投入2amolPCl5反应达平衡时,PCl5所占体积分数为N%,则M与N的关系正确的是( )
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
1.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法错误的是( )
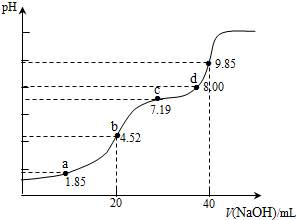

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
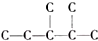 ,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.
,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH. 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.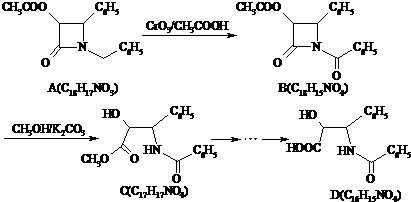
 .
.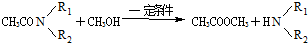
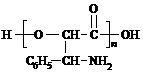 或
或 ;
;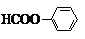 或
或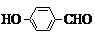 .
.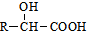 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl